

分析 原料中加入硫酸酸化,可生成硫酸钙沉淀,减压过滤后加入过氧化氢氧化可生成硫酸铁,加入硫酸铵,在80℃下反应可生成硫酸铁铵,经蒸发浓缩、冷却结晶、过滤洗涤,最后经常温晾晒可到纯净的硫酸铁铵,
(1)硫酸亚铁中亚铁离子水解,硫酸可以抑制水解,硫酸根离子可以将钙离子沉淀;
(2)加入氧化剂可氧化亚铁离子,但应避免引入新杂质;
(3)硫酸铁铵经蒸发浓缩、冷却结晶、过滤洗涤;
(4)上述流程中,氧化之后和加热蒸发之前,防止铁离子水解,用铁氰化钾溶液可以检验亚铁离子的存在;
(5)根据元素守恒结合发生的转化来计算;
解答 解:(1)加入硫酸,可增大溶液中SO42-浓度,将Ca2+转化为沉淀,生成CaSO4,同时抑制Fe2+水解,
故答案为:增大溶液中SO42-浓度,将Ca2+转化为沉淀同时抑制Fe2+水解;
(2)为避免引入新杂质,应加入过氧化氢为氧化剂,还原产物是水,
故选b;
(3)在80℃下反应可生成硫酸铁铵,经蒸发浓缩、冷却结晶、过滤洗涤,所以操作甲为冷却结晶,
故答案为:冷却结晶;
(4)上述流程中,氧化之后和加热蒸发之前,防止铁离子水解,所以要加适量的硫酸,检验Fe2+是否已全部被氧化的方法是,在溶液中加入铁氰化钾溶液若生成蓝色沉淀,可说明含有亚铁离子,
故答案为:硫酸;不加入铁氰化钾溶液若生成蓝色沉淀,可说明含有亚铁离子;
(5)称取14.00g样品,将其溶于水配置成100mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14g沉淀,应为Fe(OH)3,
n(Fe(OH)3)=$\frac{2.14g}{107g/mol}$=0.02mol,
向另一份溶液中加入0.05mol Ba(NO3)2溶液,恰好完全反应,则n(SO42-)=0.05mol,
所以14.00g样品中含有Fe2(SO4)30.02mol,n(SO42-)为0.1mol,则(NH4)2SO4为0.1mol-0.02mol×3=0.04mol,
则m(H2O)=14.00g-0.02mol×400g/mol-0.04mol×132g/mol=0.72g,
n(H2O)=$\frac{0.72g}{18g/mol}$=0.04mol,
n(Fe2(SO4)3):n((NH4)2SO4):n(H2O)=0.02:0.04:0.04=1:2:2,
所以化学式为Fe2(SO4)3•2(NH4)2SO4•2H2O,
故答案为:Fe2(SO4)3•2(NH4)2SO4•2H2O.
点评 本题考查考查物质的分离、提纯制备,为高考常见题型,侧重于学生的分析能力、实验能力和计算能力的考查,注意根据物质的性质把握实验原理和方法,难度较大.


科目:高中化学 来源: 题型:解答题
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
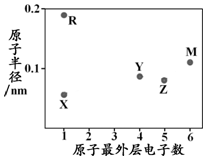
| A. | 简单阳离子半径:X<R | B. | 最高价含氧酸的酸性:Z<Y | ||
| C. | M的氢化物常温常压下为气体 | D. | X与Y可以形成正四面体结构的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图甲:进行中和热的测定 | |
| B. | 图乙:比较 HCl、H2CO3和 H2SiO3 的酸性强弱 | |
| C. | 图丙:验证 CuCl2对 H2O2 分解有催化作用 | |
| D. | 图丁:验证 2NO2(g)?N2O4(g)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
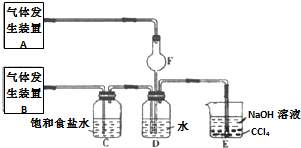
 实验室制备溴苯可用如图所示装置.填空:
实验室制备溴苯可用如图所示装置.填空: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
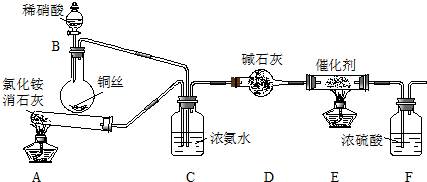
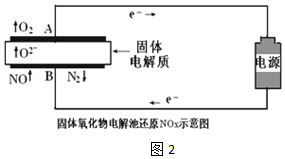
| 实验序号 | B极气体 | 电路中通过电子 | 消耗总电能 | 生成N2 |
| 实验1 | NO | 1mol | a KJ | 0.25mol |
| 实验2 | NO和空气 (不考虑NO2) | 1mol | a KJ | 0.09mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com