
【题目】在常温下,0.1000 mol/L Na2CO3溶液25 mL用0.1000 mol/L盐酸滴定,其滴定曲线如图。
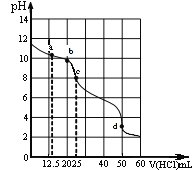
对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是
A.a点:c(CO32-)>c(HCO3-)>c(OH-)
B.b点:5c(Cl-)>4c(HCO3-)+4c(CO32-)
C.c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D.d点:c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
【答案】BD
【解析】
A.a点时n(HCl)=0.1mol/L×0.0125L=0.00125mol,反应生成0.00125molNaHCO3,剩余0.00125molNa2CO3,由于CO32-水解程度大于HCO3-电离程度,则c(HCO3-)>c(CO32-),A错误;
B.b点时n(HCl)=0.1mol/L×0.02L=0.002mol,由物料守恒可知5c(Cl-)=4c(HCO3-)+4c(CO32-)+4c(H2CO3),则5c(Cl-)> 4c(HCO3-)+ 4c(CO32-),B正确;
C.c点时n(HCl)=0.1mol/L×0.025L=0.0025mol,恰好反应生成NaHCO3,根据质子守恒得c(OH-)+c(CO32-)=c(H+)+c(H2CO3),C错误;
D.d点时加入盐酸0.005mol,与碳酸钠完全反应,溶液存在电荷守恒:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)+c(Cl-),由于c(Na+)=c(Cl-),则 c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),D正确。
答案为BD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】乙二胺(H2NCH2CH2NH2)是二元弱碱,在水中的电离原理类似于氨。常温下,向乙二胺溶液中滴加稀盐酸,溶液的pH随离子浓度变化关系如图所示。下列叙述不正确的是( )
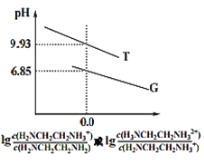
A.Kb2[H2NCH2CH2NH2]的数量级为10-8
B.曲线G代表pH与lg![]() 的变化关系
的变化关系
C.H3NCH2CH2NH2Cl溶液中c(H+)>c(OH-)
D.0.01mol·L-1H2NCH2CH2NH2电离度约为10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Cl2(g)+2NaOH(aq)=NaCl(aq)+NaClO(aq)+H2O(l)△Q1= 102 kJ·mol-1
3Cl2(g)+6NaOH(aq)=5NaCl(aq)+NaClO3(aq)+3H2O(1)△Q2= 422 kJ·mol-1
写出在溶液中NaClO分解生成NaClO3的热化学方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“三酸两碱”是最重要的无机化工产品,广泛用于国防、石油、纺织、冶金、食品等工业。“三酸”是指硝、硫酸和盐酸, “两碱”指烧碱和纯碱。回答下列问题:
(1)写出过量稀硝酸分别与“两碱”溶液反应的离子方程式:________
(2)请将“三酸两碱”中所含位于第三周期的元素,按原子半径由大到小的顺序排列_____
(3)氯的非金属性比硫______(填“强”或“弱”),请用两个事实说明你的结论_______
(4)某烧碱溶液中含0.1molNaOH,向该溶液通入一定量CO2,充分反应后,将所得溶液低温蒸干,得到固体的组成可能有四种情况,分别是:
①_____________________
②Na2CO3;
③_____________________
④NaHCO3。
若该固体溶于水,滴加过量盐酸,再将溶液蒸干,得到固体的质量是___g
(5)将Na2CO3溶于水得到下列数据:
水 | Na2CO3 | 混合前温度 | 混合后温度 |
35ml | 3.2g | 20 | 24.3 |
Na2CO3溶于水______(填“吸”或“放”)热,请从溶解过程热效应的角度加以解释_________
(6) Na2CO3溶液显碱性的原因是(写离子方程式) ___________ ,写出该溶液中的电荷守恒表达式:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】托卡朋(结构简式为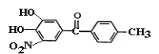 )是一种治疗帕金森氏病的药物。如图是其中的一种合成路线:
)是一种治疗帕金森氏病的药物。如图是其中的一种合成路线:
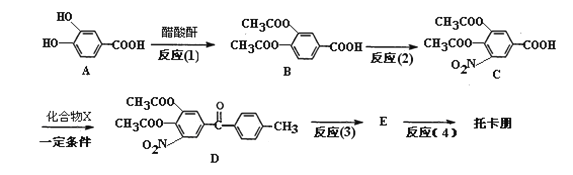
已知醋酸酐为两分子醋酸脱水形成的,结构简式为(CH3CO)2O。
(1)反应(1)的反应类型为____________,反应(2)的试剂和条件为________________。
(2)A分别与浓溴水、碳酸氢钠溶液、氢氧化钠溶液充分反应,所消耗的溴单质、碳酸氢钠、氢氧化钠的物质的量之比为________________。
(3)已知X为苯的相邻同系物,检验苯中含X的试剂为______________________。
(4)反应(1)的目的是__________________________________________________。
(5)D经过两步反应生成托卡朋,反应(3)的化学方程式为________________________。反应(4)中加入____________(试剂名称),得到托卡朋。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯、磷的化合物广泛用于农药、医药、染料等领域。
(1)PCl3与氯气、水反应,得到HCl气体和一种无色透明有刺激性臭味的液体X,实验测定,1 mol的H2O完全反应会生成2 mol的HCl,则X的组成元素是______________;已知X的相对分子质量为153.5,则X的化学式为________________。
(2)X在高温与O2发生反应,形成P4O10(固态)和Cl2。将3.07 g X与448 mLO2(已折算至标准状况,下同)在高温下充分反应后,生成Cl2____mol,气体的体积将变为_____mL。
(3)白磷在氯气中燃烧,一般得到PCl3和PCl5的混合物。2.48 g白磷(P4),与一定量的氯气恰好完全反应,产物的总质量为14.55 g,计算产物中PCl3的质量分数____________(保留3小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、R是原子序数依次增大的短周期元素。a、b、c、d、e、f是由这些元素组成的化合物,气体a的水溶液呈碱性,c为红棕色气体,f是由W、Z、R元素形成的化合物。m为元素Z形成的单质,W与X能形成化合物XW4。上述物质的转化关系如图所示,下列说法正确的是( )
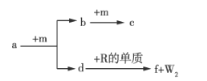
A.简单离子半径: R>Z
B.最高价氧化物对应水化物的酸性:X>Y
C.![]() 为离子化合物,含有离子键和共价键
为离子化合物,含有离子键和共价键
D.符合通式XnWn的化合物均能使溴的CCl4溶液因发生反应而褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学用语的表示正确的是( )
A.N原子的最外层电子轨道表示式: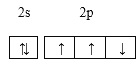
B.质子数为35、中子数为45的溴原子:![]() Br
Br
C.硫离子的结构示意图:![]()
D.间二甲苯的结构简式:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com