
 结合过氧根离子的结构分析;
结合过氧根离子的结构分析; =
= =0.5mol,含电子的物质的量为0.5mol×(2×8+2)=9mol,所以含有的电子数为9NA,故A正确;
=0.5mol,含电子的物质的量为0.5mol×(2×8+2)=9mol,所以含有的电子数为9NA,故A正确;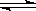 HCO3-+OH-,则1L0.1mol/LNa2CO3溶液中,阴阳离子大于0.3NA,故D错误.
HCO3-+OH-,则1L0.1mol/LNa2CO3溶液中,阴阳离子大于0.3NA,故D错误.

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com