
【题目】写出(1)~(4)原子的电子排布式,用价层电子对互斥模型推测(5)~(8)分子的空间构型。
(1)Li _______________;(2)K _______________;(3)Mg ________________;(4)Cl ______________;(5)CO2_______________;(6)SO2______________;(7)NH3_________________;(8)CH4_______________。
【答案】1s22s1 1s22s22p63s23p64s1 1s22s22p63s2 1s22s22p63s23p5 直线形 V形 三角锥形 正四面体
【解析】
(1)~(4)根据原子核外电子排布规律书写原子核外电子排布式;
(5)~(8)用价层电子对互斥理论分析空间构型。
(1)Li原子核外有3个电子,电子排布式为1s22s1;答案为:1s22s1;
(2)K原子核外有19个电子,电子排布式为1s22s22p63s23p64s1;答案为:1s22s22p63s23p64s1;
(3)Mg原子核外有12个电子,电子排布式为1s22s22p63s2;答案为:1s22s22p63s2;
(4)Cl原子核外有17个电子,电子排布式为1s22s22p63s23p5;答案为:1s22s22p63s23p5;
(5)CO2中碳原子上孤电子对数为![]() =0,σ键电子对数为2,价层电子对数为2,则CO2分子呈直线形;答案为:直线形;
=0,σ键电子对数为2,价层电子对数为2,则CO2分子呈直线形;答案为:直线形;
(6)SO2中硫原子上孤电子对数为![]() =1,σ键电子对数为2,价层电子对数为3,则SO2分子呈V形;答案为:V形;
=1,σ键电子对数为2,价层电子对数为3,则SO2分子呈V形;答案为:V形;
(7)NH3中氮原子上孤电子对数为![]() =1,σ键电子对数为3,价层电子对数为4,则NH3分子呈三角锥形;答案为:三角锥形;
=1,σ键电子对数为3,价层电子对数为4,则NH3分子呈三角锥形;答案为:三角锥形;
(8)CH4中碳原子上孤电子对数为![]() =0,σ键电子对数为4,价层电子对数为4,则CH4分子呈正四面体;答案为:正四面体。
=0,σ键电子对数为4,价层电子对数为4,则CH4分子呈正四面体;答案为:正四面体。


科目:高中化学 来源: 题型:
【题目】在某温度下,同时发生反应A(g)![]() B(g)和A(g)
B(g)和A(g)![]() C(g)。已知A(g)反应生成B(g)或C(g)的能量如图所示,下列说法正确的是
C(g)。已知A(g)反应生成B(g)或C(g)的能量如图所示,下列说法正确的是
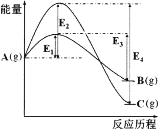
A.B(g)比C(g)稳定
B.在该温度下,反应刚开始时,产物以B为主;反应足够长时间,产物以C为主
C.反应A(g![]() )B(g)的活化能为(E3—E1)
)B(g)的活化能为(E3—E1)
D.反应A(g)![]() C(g)的ΔH<0且ΔS=0
C(g)的ΔH<0且ΔS=0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,醋酸溶液中存在电离平衡CH3COOH![]() CH3COO-+H+
CH3COO-+H+
(1)某温度时,0.1mol·L-1的醋酸溶液中的c(H+)与0.01mol·L-1的醋酸溶液中的c(H+)的比值___(填“大于”“小于”或“等于”)10;
(2)常温下0.1mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是:___;
A.c(H+) B.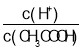 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.![]()
(3)现有pH均为3的醋酸、硫酸两瓶溶液:
①设两种溶液的物质的量浓度依次为c1、c2,则其关系式为:c1___c2(用“<”“>”或“=”表示,下同);
②取相同体积的两种酸分别加入等体积的蒸馏水后,再分别加入少量等量的锌粉,反应开始时放出氢气的速率依次为v1、v2,则其关系式为v1___v2;反应结束放出的氢气的体积依次为V1、V2,则其关系式为V1___V2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第三周期主族元素的某些性质随原子序数变化的柱形图,则y轴可表示( )
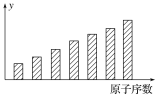
①第一电离能②电负性 ③原子半径 ④简单离子半径 ⑤最高正化合价 ⑥形成简单离子转移的电子数
A.①②③④⑤⑥B.①②③⑤
C.②④⑤D.②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用碳素钢进行了以下探究活动:
[探究一](1)将已去除表面氧化膜的碳素钢钉放入冷浓硫酸中,10min后将钢钉浸入CuSO4溶液中,钢钉表面无明显变化,其原因是 ______ .
(2)称取6.0g碳素钢放入15.0ml浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y.
①甲同学认为X中除Fe3+之外还可能含有Fe2+,若要确认是否含有Fe2+,可选用 ______ ![]() 选填序号
选填序号![]() .
.
A.KSCN溶液B.浓氨水C.酸性KMnO4溶液 D.K3[Fe(CN)6]溶液
②乙同学取560ml(标准状况)干燥气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得到干燥固体4.66g,由此可知Y中含硫化合物Q1的体积分数为 ______ .
[探究二]丙同学认为气体Y中还可能含有Q2、Q3两种气体(相同条件下Q1、Q2、Q3气体的密度依次减小).为此,设计了下列装置进行实验探究(假设有关气体完全反应).

(3)装置B中试剂的作用是 ______ .
(4)已知洗气瓶M中盛装的是澄清石灰水,为确认Q2的存在,洗气瓶M的位置应在 ______ ,产生Q2的反应的化学方程式为 ______ .
(5)确认含有气体Q3的实验现象是 ______ ,产生Q3的反应的离子方程式为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗和铝在周期表中处于对角线位置,二者的单质及化合物的性质对应相似。下列关于锗及其化合物的推断正确的是
A.锗不能与强碱溶液反应
B.氢氧化锗具有两性
C.氧化锗易溶于水
D.氧化锗的化学式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“银-Ferrozine”法检测室内甲醛含量的原理如下:

下列说法错误的是
A.标准状况下,11.2 L CO2中含C=O键的数目为6.02×1023
B.反应①的化学方程式为2Ag2O+HCHO=4Ag+CO2↑+H2O
C.理论上吸收HCHO与消耗Fe3+的物质的量之比为4:1
D.30 g HCHO被氧化时转移电子数目为4×6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com