
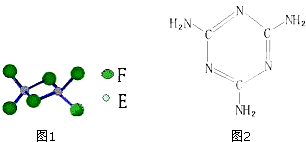
分析 A、C能形成两种化合物甲和乙,原子个数比分别为2:1和1:1,甲为常见的溶剂,这说明甲是水,则A为H元素,C为O元素,乙为双氧水;B、C相邻且同周期,且B的原子序数小于氧元素的,则B是N元素;E是地壳中含量最多的金属元素,属于E是Al元素;A、D同主族,且D的原子序数小于铝的,所以D是Na元素;F元素为同周期电负性最大的元素,且F的原子序数大于铝元素的,所以F是Cl元素;D和F可形成化合物丙,则丙是NaCl,E和F可形成化合物丁,则丁是氯化铝;G为第四周期未成对电子数最多的元素,因此G是Cr元素,据此答题.
解答 解:A、C能形成两种化合物甲和乙,原子个数比分别为2:1和1:1,甲为常见的溶剂,这说明甲是水,则A为H元素,C为O元素,乙为双氧水;B、C相邻且同周期,且B的原子序数小于氧元素的,则B是N元素;E是地壳中含量最多的金属元素,属于E是Al元素;A、D同主族,且D的原子序数小于铝的,所以D是Na元素;F元素为同周期电负性最大的元素,且F的原子序数大于铝元素的,所以F是Cl元素;D和F可形成化合物丙,则丙是NaCl,E和F可形成化合物丁,则丁是氯化铝;G为第四周期未成对电子数最多的元素,因此G是Cr元素,
(1)G为Cr元素,根据构造原理可知,3d轨道处于半满状态比较稳定,则Cr的基态原子的外围电子排布式为:3d54s1,
故答案为:3d54s1;
(2)由于O原子核外价电子排布式2s22p4,而N原子核外价电子排布式2s22p3,2p亚层属于半充满的稳定结构,难失去一个电子,因此第一电离能较大的为N元素,
故答案为:N; N原子价电子为2s22p3,2p轨道半充满,能量较低,难失1个电子,因此第一电离能较大;
(3)根据分析可知,甲为水,乙为双氧水,含有非极性共价键的是H2O2,
故答案为:H2O2;
(4)①根据图1可知,丁是Al2Cl6,丁熔点190℃,沸点183℃,则丁为分子晶体,而丙是NaCl,属于离子晶体,所以熔点、沸点较低的为Al2Cl6,
故答案为:NaCl;Al2Cl6为分子晶体,NaCl属于离子晶体;
②Al2Cl6是分子晶体,分子间存在范德华力,分子内有极性共价键和配位键,
故选:BDE;
(5)甲为水,元素F为Cl,配合物戊由G3+与甲、元素F构成;生成的28.7g白色沉淀是AgCl,氯化银的物质的量为:$\frac{28.7g}{143.5g/mol}$=0.2mol,0.1mol戊能够电离出0.2mol氯离子,说明该化合物能电离出2个氯离子,再根据配位数是6以及Cr元素的化合价为+3价可知,戊中含有5个水分子、1个氯离子,则戊的化学式为:[Cr(H2O)5Cl]Cl2,
故答案为:[Cr(H2O)5Cl]Cl2;
(6)根据三聚氰胺的结构简式可知,C=N中为平面结构,-NH2中为三角锥结构,杂化形式分别是sp2、sp3,
故答案为:sp2、sp3.
点评 本题考查位置结构与性质的关系,比较全面考查学生有关元素推断知识和灵活运用知识的能力,有利于培养学生的应试能力和逻辑推理能力,题目难度中等.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; ;
; 的最合理的方案.用合成反应流程图表示,书写模式如下:
的最合理的方案.用合成反应流程图表示,书写模式如下: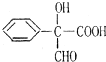
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
. CH3COOC2H5+H2O;反应类型:酯化反应.
CH3COOC2H5+H2O;反应类型:酯化反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 1 mol/L AlCl3溶液 | B. | 200 mL 1 mol/L MgCl2溶液 | ||
| C. | 100 mL 0.5 mol/L CaCl2溶液 | D. | 100 mL 2 mol/L KCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
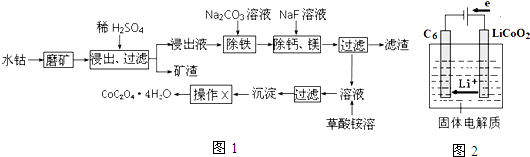
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com