
| A. | 热稳定性:HF>HCl>H2Se | B. | 原子半径:Br>Se>Cl | ||
| C. | 还原性:I->Se2->Cl- | D. | 酸性:HBrO4>H2SeO4>HClO4 |
分析 元素周期表中,同一周期元素从左到右,原子半径逐渐减小、非金属性逐渐增强,同主族自上而下,原子半径增大、元素的非金属性减弱,元素的非金属性越强,对应的氢化物越稳定,阴离子的还原性越弱,最高价氧化物对应的水化物的酸性越强,以此来解答.
解答 解:A.非金属性F>Cl>S,元素的非金属性越强,对应的氢化物越稳定,则热稳定性:HF>HCl>H2Se,故A正确;
B.同周期元素从左到右,原子半径逐渐减小,同主族元素从上到下,原子半径逐渐增大,则应有Se>Br>Cl,故B错误;
C.非金属性Cl>S>Se,元素的非金属性越强,对应的阴离子的还原性越弱,则还原性Se2->S2->Cl-,故C错误;
D.非金属性Cl>Br>Se,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性HClO4>HBrO4>H2SeO4,故D错误,
故选A.
点评 本题考查元素周期表和周期律的应用,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意同主族元素性质的变化规律及应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 两种分子的中心原子的杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3杂化 | |
| B. | NH3分子中氮原子形成3个杂化轨道,CH4分子中碳原子形成4个杂化轨道 | |
| C. | NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强 | |
| D. | 氨气分子是四原子化合物,甲烷为五原子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH2分子中6个原子都共面,而CH3CH═CH2分子中最多有7个原子共面 | |
| B. | 苯是平面正六边形分子,其中存在单双键交替的结构 | |
| C. | 正戊烷分子中的碳原子之间以碳碳单键结合成直线状 | |
| D. | CH3Cl没有同分异构体说明CH4是正四面体结构,而非平面正方形 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖、淀粉、纤维素水解的最终产物都是葡萄糖 | |
| B. | 误服重金属盐,立即服用牛奶或豆浆可解毒 | |
| C. | 油脂、乙酸乙酯都属于酯类,但不是同系物 | |
| D. | 室温下,在水中的溶解度:甘油>苯酚>1-氯丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
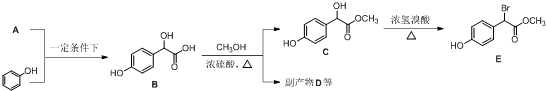
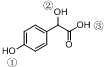 中①、②、③3个-OH的酸性由强到弱的顺为③>①>②;写出B与过量Na2CO3溶液反应的化学方程式
中①、②、③3个-OH的酸性由强到弱的顺为③>①>②;写出B与过量Na2CO3溶液反应的化学方程式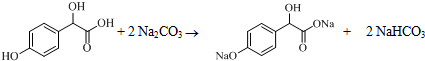 .
.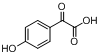 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$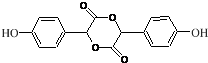 +2H2O.
+2H2O.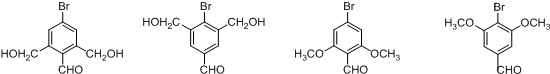 (不考虑立体异构).
(不考虑立体异构).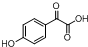 的合成路线图.
的合成路线图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO不属于大气污染物 | B. | NO能溶于水 | ||
| C. | NO易与空气中的氧气化合 | D. | NO可用排空气法收集 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-32 | 4.1 | - |
| Fe(OH)3 | 3.5×10-38 | 2.2 | 3.5 |
| Fe(OH)2 | 1.0×10-15 | 7.5 | 9.5 |
| Ni(OH)2 | 6.5×10-18 | 6.4 | 8.4 |
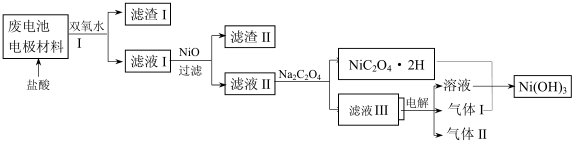
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com