
| 加入试剂 | 0.1mol/LH2C2O4溶液 | 0.2mol/LH2C2O4溶液 |
| 实验现象 | ||
| 褪色时间 | 16s | 9s |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、若图I为合成氨,则其中N2、H2可循环使用 |
| B、若图I为合成SO3,则其中SO2、O2可循环使用 |
| C、若图Ⅱ为电解熔融MgCl2得到镁,则其中HCl可循环使用 |
| D、若图Ⅲ为氨氧化法制硝酸,则其中NO2可循环使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如下图.材料1:NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物.如:2NH3+3CuO
某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如下图.材料1:NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物.如:2NH3+3CuO
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:3 | B、2:3 |
| C、3:1 | D、3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
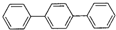 它的分子式为
它的分子式为
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(CO2)×c(H2) |
| c(CO)×c(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定温度下,当弱酸的浓度相同时,电离常数越大,酸性越强 |
| B、合成氨的反应,正反应的平衡常数和逆反应的平衡常数相同 |
| C、实验测定酸碱滴定曲线时,要保证整个过程测试和记录pH的间隔相同 |
| D、pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com