
分析 首先,根据题目中的信息,判断酸性顺序:第一步电离程度远大于第二步电离程度,第二步电离程度远大于第三步电离程度,得到
H2B>HB-、H3C>H2C->HC2-,它们之间能发生下列反应,得到
①HA+HC2-(少量)=A-+H2C- 即HA>H2C-,同时,即使HA过量,也只能生成H2C-,而不是H3C,说明HA<H3C,
②H2B(少量)+2A-=2HA+B2-即H2B>HA,同时,由于H2B很少,并生成B2-,即说明H2B将2个H+都给了A-,即HB-也能将H+给A-,
即说明H2B>HB->HA;
③H2B(少量)+H2C-=HB-+H3C即H2B>H3C,但是生成HB-,即说明HB-不能将H+提供,即HB-<H3C,即H2B>H3C>HB-
综合,得到H2B>H3C>HB->HA>H2C->HC2-
然后根据酸性强弱顺序进行判断.
解答 解:(1)根据题目中的信息,判断酸性顺序:第一步电离程度远大于第二步电离程度,第二步电离程度远大于第三步电离程度,得到
H2B>HB-H3C>H2C->HC2-它们之间能发生下列反应,
①HA+HC2-(少量)=A-+H2C-,即HA>H2C-,同时,即使HA过量,也只能生成H2C-,而不是H3C,说明HA<H3C,
②H2B(少量)+2A-=2HA+B2-,即H2B>HA,同时,由于H2B很少,并生成B2-,即说明H2B将2个H+都给了A-,即HB-也能将H+给A-,
即说明H2B>HB->HA,
③H2B(少量)+H2C-=HB-+H3C,
即H2B>H3C,但是生成HB-,即说明HB-不能将H+提供,即HB-<H3C,即H2B>H3C>HB-,
综合信息得到H2B>H3C>HB->HA>H2C->HC2-,所以最强的酸为H2B,
故答案为:H2B;
(2)由以上酸性强弱顺序知:物质的酸性越强,其对应酸根离子结合质子的能力越弱,反之越强,所以最易结合质子的是C3-,最难结合质子的是HB-.
故答案为:C3-;HB-;
(3)根据H2B>H3C>HB->HA>H2C->HC2-,以及强酸制弱酸的原则,故离子方程式为:A、H3C+A-=HA+H2C-;B、HB-+A-=HA+B2-;C、H3C+B2-=HB-+H2C-;
故答案为:BC;
(4)过量的氢氧根离子能够将酸中的氢离子完全中和,所以其反应的离子方程式为:H3C+3OH-=3H2O+C3-,
根据H2B>H3C>HB->HA>H2C->HC2-,以及强酸制弱酸的原则,过量HA与C3-反应的离子方程式为:2HA+C3-=2A-+H2C-,
故答案为:H3C+3OH-=3H2O+C3-;2HA+C3-=2A-+H2C-.
点评 本题综合考查弱电解质的电离,题目难度中等,做题时注意把握“较强酸+较弱酸盐→较强酸盐+较弱酸”的反应规律,侧重于考查学生的分析能力和对所学原理的应用能力.


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子数之比为1:1 | B. | 原子数之比为1:1 | C. | 中子数之比为1:1 | D. | 密度之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的燃烧热为566.0 kJ•mol-1 | |
| B. | 2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 | |
| C. | 完全燃烧20g甲醇,生成二氧化碳和液态水时放出的热量为908.3 kJ | |
| D. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)a=-1453.28 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
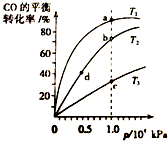 用CO合成甲醇的反应为:CO(g)+2H2(g)═CH3OH (g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
用CO合成甲醇的反应为:CO(g)+2H2(g)═CH3OH (g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )| A. | 温度:T1>T2>T3 | B. | 正反应速率:v(a)>v(c) v(b)>v(d) | ||
| C. | 平衡常数:K(a)>K(b) K(b)=K(d) | D. | 平均摩尔质量:M(a)>M(c) M(b)<M(d) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ③⑥ | C. | ③ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
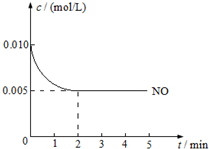 2NO(g)+O2(g)?2NO2(g)△H<0是制造硝酸的重要反应之一.在800℃时,向容积为1L的密闭容器中充入0.010mol NO和0.005molO2,反应过程中NO的浓度随时间变化如图所示:
2NO(g)+O2(g)?2NO2(g)△H<0是制造硝酸的重要反应之一.在800℃时,向容积为1L的密闭容器中充入0.010mol NO和0.005molO2,反应过程中NO的浓度随时间变化如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com