

分析 (1)A.容量瓶用来配制一定物质的量浓度的溶液,使用前要先检查容量瓶是否漏液,不能用来加热,不能用容量瓶贮存配制好的溶液,250mL容量瓶不能用来配制500mL溶液,只能配制250mL溶液;
B.分离胶体与溶液用渗析法;
C.甘油与水相互溶解;
D.酸式滴定管用来量取具有酸性和氧化性物质;
E.测定pH最简单的方法是使用pH试纸,测定时,用玻璃棒蘸取待测溶液,滴在试纸上,然后再与标准比色卡对照;
F.银和氨水不反应;
G.氨水和硝酸银反应生成AgOH,AgOH继续与氨水反应生成银氨络离子;
J.胶体遇电解质溶液发生聚沉;
K.硝酸钾和氯化钠的溶解度受温度的影响不同;
(2)量筒读书时要读取凹液面的最低点,对一般像量筒一样,从下到上数字增大的仪器来说,读数时仰视读数会使结果小于实际值,俯视读数会使结果大于实际值,若从下到上数字减小,则结果相反;
(1)①依据c=$\frac{1000ρω}{M}$计算盐酸的物质的量浓度;
②Ⅰ根据配制500mL物质的量浓度为0.3mol/L稀盐酸需要的氯化氢的物质的量计算出浓盐酸的体积;
II.分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)A.容量瓶是配制一定物质的量浓度的溶液的专用仪器,500mL溶液不能用两个250mL容量瓶配制,只能配制500mL溶液,故A错误;
B.淀粉溶于水得到胶体,NaCl溶于水得到溶液,可以用渗析法分离胶体与溶液,故B正确;
C.分液漏斗分离的是两种互不相溶的液体,甘油与水相互溶解,所以不能用分液漏斗分离,故C正确;
D.高锰酸钾具有氧化性,应用酸性滴定管量取,故D正确;
E.pH试纸先用水润湿再浸入待测,这样的操作会使溶液变稀,是测量的数据不准确,故E错误;
F.银镜反应实验后附有银,银和氨水不反应,银镜反应实验后附有银的试管,可以用硝酸来洗,故F错误;
G.氨水和硝酸银反应生成AgOH,AgOH继续与氨水反应生成银氨络离子,符合操作,故G正确;
J.硫酸是电解质溶液,能使胶体发生聚沉,故J正确;
K.硝酸钾溶解度随温度升高增加的大,氯化钠增加的少,高温的混合液,降温后硝酸钾溶解度降低较大,从溶液中析出,氯化钠本身少,溶解度降低不大,仍然不饱和,不析出,所以能用结晶法可以除去硝酸钾中混有的少量氯化钠,故K正确;
故答案为:BCDGJK;
(2)量筒读数时要读凹液面的最低点,且精确度为0.1,则读数为28.0 mL,仰视读数,对量筒等从下到上数值增大的仪器来说是所读数值比实际值偏小,而此处偏大了,故刻度为从下到上逐渐减小,故选C,
故答案为:28.0;C;
(3)①浓盐酸的物质的量浓度为:$\frac{1000×1.2×36.5%}{36.5}$=12mol/L;
故答案为:12;
Ⅰ溶液稀释过程中溶质的物质的量不变,则依据c1V1=c2V2,
12mol/L×V1=0.300mol•L-1×0.5L,
所以V1=0.0125L=12.5mL
故答案为:12.5;
II.A.用量筒量取浓盐酸时俯视观察凹液面,导致量取浓盐酸体积偏小,溶质的物质的量偏小,溶液浓度偏低,故A不选;
B.溶液注入容量瓶前没有恢复到室温就进行定容,冷却后液面下降,溶液体积偏小,溶液浓度偏高,故B选;
C.定容时仰视刻度线,导致溶液体积偏大,溶液浓度偏低,故C不选;
D.在配制前用已知浓度的稀盐酸润洗容量瓶,导致溶质偏大,溶液浓度偏高,故D选;
故选:BD.
点评 本题考查了物质的量浓度的有关计算及配置一定物质的量浓度的溶液误差分析,明确配制原理及操作步骤是解题关键,注意常见计量仪器使用方法和注意事项,注意误差分析的方法,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑧ | B. | ④⑤⑦⑨ | C. | ③④⑤⑨ | D. | ④⑤⑨⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
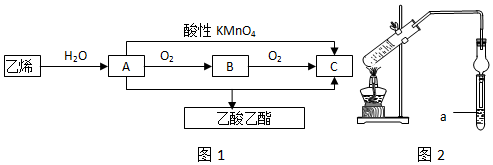
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 它的二氯代物又有10种,立方烷
它的二氯代物又有10种,立方烷  它的六氯代物有3种.
它的六氯代物有3种. 分子中最多有25个原子共面.
分子中最多有25个原子共面.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯通入酸性高锰酸钾溶液中,高锰酸钾溶液褪色 | |
| B. | 含碳原子较多的烷烃加热、加压、催化剂条件下反应生成含碳原子较少的烷烃和烯烃 | |
| C. | 在光照条件下,C2H6与Cl2反应生成了油状液体 | |
| D. | 在催化剂作用下,乙烯与水反应生成乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LCH3COOH溶液的pH>1:CH3COOH?CH3COO-+H+ | |
| B. | “NO2球”浸泡在冷水中,颜色变浅:2NO2(g)?N2O4(g)△H<0 | |
| C. | 向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O?Al(OH)3(胶体)+3H+ | |
| D. | 用催化法处理汽车尾气中的CO和NO:CO+NO$\frac{\underline{\;催化剂\;}}{\;}$C+NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com