
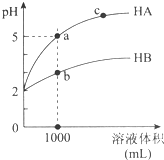
 室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( )
室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( )| A. | HA的酸性比HB的酸性弱 | |
| B. | a点溶液的导电性比c点溶液的导电性弱 | |
| C. | 若两溶液无限稀释,则它们的c(H+)相等 | |
| D. | 对a、b两点溶液同时升高温度,则$\frac{c({A}^{-})}{{c(B}^{-})}$增大 |
分析 室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,HA溶液PH=5,说明HA为强酸,HB为弱酸,
A.pH均为2的两种一元酸HA和HB各1mL,分别加水稀释相同倍数,酸性强的PH变化大;
B.a点溶液中离子浓度大于c点溶液中离子浓度,溶液导电性取决于离子浓度大小;
C.溶液无限稀释接近为水的电离,氢离子浓度接近为10-7;
D.HA为强酸,HB为弱酸,对a、b两点溶液同时升高温度,HB电离程度增大,c(B)浓度增大.
解答 解:室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,HA溶液PH=5,说明HA为强酸,HB为弱酸;
A.pH均为2的两种一元酸HA和HB各1mL,分别加水稀释1000倍,HA溶液PH=5,HB溶液PH小于5,HA的酸性比HB的酸性强,故A错误;
B.a点溶液中离子浓度大于c点溶液中离子浓度,溶液导电性取决于离子浓度大小,则a点溶液的导电性比c点溶液的导电性强,故B错误;
C.溶液无限稀释接近为水的电离,氢离子浓度接近为10-7,若两溶液无限稀释,则它们的c(H+)相等,故C正确;
D.HA为强酸,HB为弱酸,对a、b两点溶液同时升高温度,c(A)浓度不变,HB电离程度增大,c(B)浓度增大,$\frac{c(A)}{c(B)}$比值减小,故D错误,故D错误;
故选C.
点评 本题考查了弱电解质电离平衡影响因素、图象的分析判断、溶液稀释过程中离子浓度变化,掌握基础是解题关键,题目难度中等.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 7.8gNa2O2中所含有的阴离子数目是0.2NA | |
| B. | 标准状况下,2.24L18O2中含有的中子的数目是NA | |
| C. | 在20℃、1.01×105 Pa时,2.8g C2H4和CO的混合气体含气体分子数是0.1 NA | |
| D. | 标准状况下,a L CH4和a L C6H14中所含分子数均约为$\frac{a{N}_{A}}{22.4}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粒子种类不相同 | B. | c(OH-)前者大于后者 | ||
| C. | 均存在电离平衡和水解平衡 | D. | 分别加入NaOH固体,c(CO32-)均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | C2H4 | C3H4 | C4H10 | C5H10 | C6H10 | C7H16 |
| A. | C7H18 | B. | C7H14 | C. | C8H18 | D. | C8H16 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
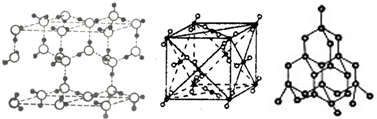
| A. | 冰晶体中只存在分子间作用力和氢键 | |
| B. | 沸点:金刚石>干冰>冰 | |
| C. | 冰晶体中的氧原子和金刚石中的碳原子可形成四面体结构 | |
| D. | 干冰晶体中每个CO2周围等距离且最近的CO2有10 个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||||||
| Y | Z | W |
| A. | 工业上电解YW饱和溶液冶炼金属Y | |
| B. | 气态氢化物的稳定性:W>X | |
| C. | Y、W的最高价氧化物的水化物均能溶解金属Z | |
| D. | 简单离子半径的大小顺序:r(Y+)>r(X-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com