
【题目】请回答下列问题
(1)向煮沸的蒸馏水中逐滴加入饱和FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体的离子方程式为_______________________。
(2)Ca(OH)2的电离方程式为_______________。
(3)现有下列物质:①干冰②NaHCO3晶体③氨水④纯醋酸⑤FeCl3溶液⑥铜⑦蔗糖⑧熔化的NaCl,其中属于非电解质的是___________(填序号,下同),属于强电解质的有____________,属于弱电解质的有________________,能导电的物质有________________。
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示。向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀H2SO4至恰好完全反应。在此实验过程中,此实验中观察到的现象有___________________________________________。
(5)下列说法正确的是_________________。
①碱性氧化物一定是金属氧化物;
②酸性氧化物一定是非金属氧化物;
③乳浊液静止后分层;
④Mg2+、SO42-、Fe3+、X四种离子以物质的量之比1:2:1:1大量共存于同一水溶液中,X可能是NO3﹣;
⑤碳酸钙是强电解质
【答案】Fe3++3H2O(沸水) ![]() Fe(OH)3(胶体)+3H+ Ca(OH)2=Ca2++2OH- ①⑦ ②⑧ ④ ③⑤⑥⑧ 溶液中有白色沉淀生成;塑料小球沉入水中 ①③④⑤
Fe(OH)3(胶体)+3H+ Ca(OH)2=Ca2++2OH- ①⑦ ②⑧ ④ ③⑤⑥⑧ 溶液中有白色沉淀生成;塑料小球沉入水中 ①③④⑤
【解析】
(1)向煮沸的蒸馏水中逐滴加入饱和FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热,可制得Fe(OH)3胶体,反应的离子方程式为Fe3++3H2O(沸水)![]() Fe(OH)3(胶体)+3H+。
Fe(OH)3(胶体)+3H+。
(2)Ca(OH)2是二元强碱,其电离方程式为Ca(OH)2=Ca2++2OH-。
(3)溶于水和在熔融状态下不能导电的化合物是非电解质,溶于水完全电离的电解质是强电解质,部分电离存在电离平衡的电解质是弱电解质。含有自由移动电子或离子的物质可以导电。则
①干冰是二氧化碳,不能自身电离,是非电解质;
②NaHCO3晶体不存在自由移动的电子,不导电,溶于水完全电离是强电解质;
③氨水中含有自由移动的离子,可以导电,属于混合物,不是电解质,也不是非电解质;
④纯醋酸不存在自由移动的电子,不导电,溶于水部分电离是弱电解质;
⑤FeCl3溶液中含有自由移动的离子,可以导电,属于混合物,不是电解质,也不是非电解质;
⑥铜是金属单质,能导电,不是电解质,也不是非电解质;
⑦蔗糖不能自身电离,不导电,是非电解质;
⑧熔化的NaCl含有自由移动的离子,可以导电,完全电离,是强电解质。
因此其中属于非电解质的是①⑦,属于强电解质的有②⑧,属于弱电解质的有④,能导电的物质有③⑤⑥⑧。
(4)由题意可知,恰好完全反应的方程式为H2SO4+Ba(OH)2=BaSO4↓+2H2O,则可观察到溶液里有白色沉淀产生,又溶液的密度变小,则在溶液中央悬浮的塑料小球将下降到烧杯底部;
(5)①能与酸反应生成盐和水的氧化物是碱性氧化物,碱性氧化物一定是金属氧化物,①正确;
②能与碱反应生成盐和水的氧化物是酸性氧化物,酸性氧化物不一定是非金属氧化物,例如Mn2O7是酸性氧化物,属于金属氧化物,②错误;
③乳浊液是指由两种不相溶的液体所组成的分散系,即一种液体以小液滴的形式分散在另外一种液体之中形成的混合物,因此乳浊液静止后分层,③正确;
④Mg2+、SO42-、Fe3+、X四种离子以物质的量之比1:2:1:1大量共存于同一水溶液中,根据电荷守恒可知X应该带1个单位负电荷,则X可能是NO3﹣,④正确;
⑤碳酸钙溶于水的部分能完全电离出阴、阳离子,是强电解质,⑤正确。
答案选①③④⑤。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】![]() 是重要的工业原料,铀浓缩一直为国际社会关注。下列说法正确的是
是重要的工业原料,铀浓缩一直为国际社会关注。下列说法正确的是
A. ![]() 原子核中含有92个中子 B.
原子核中含有92个中子 B. ![]() 原子核外有143个电子
原子核外有143个电子
C. ![]() 与
与![]() 互为同位素 D.
互为同位素 D. ![]() 与
与![]() 为同一核素
为同一核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH的混合溶液中逐渐通入CO2气体至过量,生成沉淀的物质的量(n)和通入CO2气体的(V) 的关系如图所示,试回答:

(1)0到a点之间的反应的离子方程式__________
(2)a到b点之间的反应的离子方程式__________
(3)b点之后的反应的离子方程式______________
(4)c 点CO2的体积__________mL(同温同压下)。
(5) 混合溶液中Ba(OH)2和NaOH 的物质的量之比为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是由4个碳原子结合成的6种有机物(氢原子没有画出)
![]()
(1) 写出有机物(a)的系统命名法的名称___________________。
(2) 有机物(a)有一种同分异构体,试写出其结构简式__________________。
(3) 上述有机物中与(c)互为同分异构体的是________(填代号)。
(4) 任写一种与(e)互为同系物的有机物的结构简式____________。
(5) 上述有机物中不能与溴反应并使其褪色的有________(填代号)。
(6) (a)(b)(c)(d)四种物质中,4个碳原子一定处于同一平面的有________(填代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是 ( )
A. 0.1 mol·L-1 NH4HS溶液中有:c(NH![]() )+c(NH3·H2O)=c(HS-)+c(S2-)+c(H2S)
)+c(NH3·H2O)=c(HS-)+c(S2-)+c(H2S)
B. 25 ℃时,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合后,c(NH![]() )=c(Cl-),则a>0.01mol·L-1
)=c(Cl-),则a>0.01mol·L-1
C. 等浓度的HCN和NaCN等体积混合后溶液呈碱性,则有:c(CN-)>c(HCN)
D. 等体积等pH的醋酸和盐酸溶液,分别与一定浓度的氢氧化钠溶液完全中和,醋酸消耗的氢氧化钠溶液体积多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:2Zn(s) + O2(g) =2ZnO(s) ΔH1=-702.2kJ/mol
Hg(l) + ![]() O2(g) =HgO(s) ΔH2=-90.7kJ/mol
O2(g) =HgO(s) ΔH2=-90.7kJ/mol
由此可知Zn(s) + HgO(s) = ZnO(s) + Hg(l)的ΔH3 ,其中ΔH3的值是( )
A. -260.4 kJ/mol B. -254.6 kJ/mol
C. -438.9 kJ/mol D. -441.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧电池若不进行回收利用,将对水体产生严重污染。某兴趣小组对废旧镍电池正极材料[由Ni(OH)2、碳粉、Fe2O3等涂覆在铝箔上制成]进行回收研究,设计实验流程如下图所示:
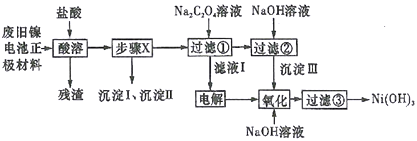
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+,Cl2能氧化Ni2+为Ni3+;
②NiO+2HCl=NiCl2+H2O;
③Fe3+、Al3+、Ni3+以氢氧化物形式沉淀时溶液的pH如下表所示:
离子 | Fe3+ | Al3+ | Ni2+ |
开始沉淀时的pH | 1.5 | 3.5 | 7.0 |
完全沉淀时的pH | 3.2 | 4.8 | 9.0 |
④Ksp[Ni(OH)2]=5.0×10-16,Ksp(NiC2O4)=4.0×10-10。
请回答下列问题:
(1)酸溶后所留残渣的主要成份__________(填物质名称)。
(2)步骤X的操作为用NiO调节溶液pH,首先析出的沉淀Ⅰ是__________(填化学式),调节过程中pH不能低于___________。
(3)已知溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O,则加入Na2C2O4溶液后析出的沉淀是__________。
(4)写出生成沉淀Ⅲ的离子方程式__________,该反应的平衡常数为__________。
(5)用化学反应方程式表示沉淀Ⅲ转化为Ni(OH)3________________________。
(6)过滤③后如何检验Ni(OH)3已洗涤干净____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列化合物:①NH4Al(SO4)2、②NH4HSO4、③NH4Cl、④NH3H2O、⑤CH3COONH4, 回答下列问题。
(1)NH4HSO4 的电离方程式为_____
(2)等浓度的②④⑤三种溶液中,NH4+浓度由大到小的顺序是__________。(用序号表示)
(3)室温时,pH=3 的 NH4Cl 溶液中:c(C1ˉ)-c(NH4+) =_________mol·L-1 (填数值)
(4)NH4Al(SO4)2可作净水剂,其理由是___________________________________用必要的化学用语和相关文字说明)
(5)将浓度均为 0.1 mol·L﹣1 的③和④溶液混合,关于所得溶液下列说法错误的是_____
A.若溶液显酸性,则 c(C1ˉ)>c(NH4+ )>c(H+ )>c(OH- )
B.若 c(C1ˉ)=c(NH4+),则溶液显中性
C.若③和④等体积混合,则所得溶液满足关系:c(NH4+)+c(NH3H2O)=0.2mol·L-1
D.其浓度大小不可能为:c(C1ˉ)>c(NH4+)>c(OHˉ)>c(H+)
(6)已知 CH3COONH4 溶液为中性,试推断(NH4)2CO3 溶液的 pH________7 (填“<”“>”“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.仅由非金属元素不可能形成离子化合物
B.构成分子的粒子一定含有共价键
C.离子化合物中可能含有共价键
D.凡是有化学键断裂过程一定发生了化学反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com