
| A. | ①④ | B. | ②⑤ | C. | ③④ | D. | ②④ |
分析 ①标况下,己烯为液态;
②根据气体摩尔体积的条件应用计算;
③氯气和氢氧化钠反应是氯气自身氧化还原反应,1molCl2反应电子转移1mol;
④依据乙醇分子结构计算共价键数;
⑤依据硫酸铝化学式的构成离子和浓度体积与物质的量的换算关系计算判断;
解答 解:①己烯标准状况下不是气体,22.4L已烯物质的量不是1mol,故①错误;
②标准状况下,aL的氧气和氮气的混合物含有的分子数=$\frac{a}{22.4}$×6.02×1023,故②正确;
③氯气和氢氧化钠反应是氯气自身氧化还原反应,1molCl2反应电子转移1mol;7.1g氯气物质的量为0.1mol,与足量的氢氧化钠溶液反应转移的电子数约为0.1×6.02×1023,故③错误;
④乙醇分子结构分析计算,1mol乙醇中含有的共价键数8NA,为8×6.02×1023,故⑤错误;
⑤500mL 1mol/L的硫酸铝溶液中含硫酸铝物质的量为0.5mol,化学式Al2(SO4)3;所以含硫酸根离子物质的量为1.5mol,含有的硫酸根离子数约为1.5×6.02×1023,故⑥正确;
综上所述:②⑤正确,
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:选择题
| A. | 原溶液肯定只存在NH4+、SO32- | |
| B. | 原溶液一定不含Ba2+、Fe3+、I- | |
| C. | 原溶液可能存在K+、SO42- | |
| D. | 另取试液滴加足量盐酸、BaCl2溶液,即可确定溶液离子组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 71gNa2SO4固体中含钠离子数目为NA | |
| B. | 28g由乙烯和丙烯组成的混合气体中含碳碳双键数目为NA | |
| C. | 标准状况下,22.4LHF中含HF分子数目为NA | |
| D. | 25g质量分数为68%的H2O2水溶液中含氧原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 实验内容 | 实验目的 |
| A | 向盛有10滴0.1 mol•L-1AgNO3溶液的试管中滴加0.1mol•L-1 NaCl溶液,至不再有沉淀生成,再向其中滴加0.1mol•L-1 Na2S溶液 | 证明AgCl能转化为溶解度更小的Ag2S |
| B | 取某溶液少量,加入盐酸酸化的氯化钡溶液,出现白色沉淀 | 证明该溶液中一定含有大量的SO42- |
| C | 向某卤代烃中加入NaOH溶液,加热一段时间后,加入AgNO3溶液 | 检验卤代烃中的卤素原子 |
| D | 向纯碱中滴加足量盐酸,将产生的气体通入苯酚钠溶液 | 证明酸性:盐酸>碳酸>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
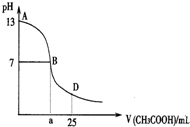 下图为向25mL 0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与
下图为向25mL 0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与| A. | c(OH-)一定大于c(CH3COO-) | B. | c(OH-)一定小于c(CH3COO-) | ||
| C. | c(OH-)一定等于c(CH3COO-) | D. | c(OH-)大于、小于或等于c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 最高价氧化物对应水化物的碱性:C>D | |
| C. | 化合物AE与CE具有不同类型的化学键 | |
| D. | 一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com