
科目:高中化学 来源:不详 题型:单选题
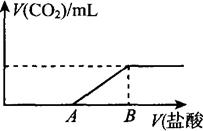
| V(A)的取值 | V(A)=0 | 0<V(A)<150 | V(A)=150 | 150<V(A)<300 |
| 溶质的成分 | ① | ② | ③ | ④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分别和盐酸反应时,混合物的耗酸量大 |
| B.分别和足量盐酸反应时,混合物放出的CO2多 |
| C.分别配制成等体积溶液,混合物的pH值大 |
| D.分别配制成等体积溶液,混合物的Na+的物质的量大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A. | B. |
C. | D. |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.小苏打可与酸反应,可用作治疗胃酸过多的药剂 |
| B.氯化铝是电解质,可电解其水溶液获得金属铝 |
| C.SO2具有漂白性,可用于将银耳漂白为“雪耳” |
| D.二氧化硅具有导电性,可用于生产光导纤维 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com