
【题目】如图所示为CH4燃料电池的装置(A、B为多孔碳棒):
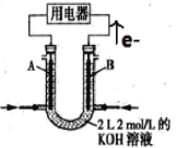
(1)_____(填A或B)处电极入口通甲烷,其电极反应式为_____________;
(2)当消耗甲烷的体积为11.2 L(标准状况下)时,消耗KOH的质量为_______g。
(3)铅蓄电池是最早使用的充电电池,由Pb、PbO2、硫酸构成。该电池工作时,正极的电极反应为____________________。
(4)500 mL KNO3和Cu(N03)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL。原混合溶液中c(K+)为_________mol·L-1。
【答案】 B CH4+10OH--8e-===CO32-+7H2O 56 PbO2+2e-+SO42-+4H+=PbSO4+2H2O 2
【解析】(1)根据电子的移动方向是有负极→外电路→正极,甲烷应通入B极,甲烷跟氧气在碱性溶液中反应生成碳酸根离子,电极反应式为CH4+10OH--8e-===CO32-+7H2O;(2)总方程式为:CH4+2O2+2OH—=CO32—+3H2O,当消耗甲烷的体积为11.2 L(标准状况下)时,根据电极方程式知,消耗KOH的质量为0.5mol![]() 6g/mol=56g;(3)铅蓄电池是最早使用的充电电池,由Pb、PbO2、硫酸构成。该电池工作时,正极PbO2得电子生成硫酸铅,其电极反应为:PbO2+2e-+SO42-+4H+=PbSO4+2H2O;(4)石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),n(O2)=
6g/mol=56g;(3)铅蓄电池是最早使用的充电电池,由Pb、PbO2、硫酸构成。该电池工作时,正极PbO2得电子生成硫酸铅,其电极反应为:PbO2+2e-+SO42-+4H+=PbSO4+2H2O;(4)石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),n(O2)=![]() =1mol,
=1mol,
阳极发生4OH--4e-═O2↑+2H2O,
4mol 1mol
阴极发生Cu2++2e-═Cu、 2H++2e-═H2↑,
1mol 2mol 1mol 2mol 1mol
c(Cu2+)=![]() =2mol/L,由电荷守恒可知,原混合溶液中c(K+)为6mol/L-2mol/L×2=2mol/L。
=2mol/L,由电荷守恒可知,原混合溶液中c(K+)为6mol/L-2mol/L×2=2mol/L。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 分子式符合Cn(H2O)m的,一定是糖类
B. 米酒变酸的过程涉及了氧化反应
C. 福尔马林是一种良好的杀毒剂,也可用来消毒自来水
D. 保护加酶洗衣粉的洗涤效果,应用沸水溶解洗衣粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境污染问题越来越受到人们的关注,造成环境污染的主要原因是由于人类生产活动中过度排放有关物质引起的。下列环境问题与所对应的物质不相关的是
A. 温室效应——CO2 B. 光化学污染——NO2
C. 酸雨——SO2 D. 臭氧层破坏——CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有Cl-、CO32-、HCO3-、OH-等四种阴离子,加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)
A.OH - B.HCO3- C.CO32- D.Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图示,下列与此原理有关说法错误的是
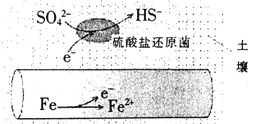
A. 正极反应为:SO42-+5H2O+8e-=HS-+9OH-
B. 输送暖气的管道不易发生此类腐蚀
C. 这种情况下,Fe腐蚀的最终产物为Fe2O3·xH2O
D. 管道上刷富锌油漆可以延缓管道的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 1mol羟基中含有的电子数为7NA
B. 1mol苯分子中含有碳碳双键数为3NA
C. 标准状况下,2.24L四氯甲烷中所含分子数为0.1NA
D. 常温下,0.1mol乙烷与乙烯混合气体中所含碳原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银锰精矿是重要的银矿资源,其主要成分为MnO2和银单质,利用黄铁矿(主要成分为FeS2)可以实现锰和银的分离。具体操作流程如下:
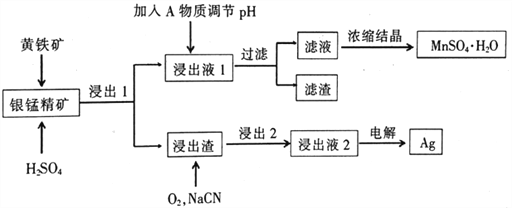
(1)提高锰元素浸出率的措施(任写—条)___________。
(2)浸出1中,黄铁矿转化为铁盐和硫酸盐,请写出发生反应的化学方程式___________。
(3)从工业生产成本考虑,加入的A最好是______________。
A.CaCO3 B.NaOH C.氨水 D.Ca(OH)2
⑷浸出液2的主要成分Ag(CN)2-,写出浸出2中发生反应的离子方程式________;电解后的溶液中,可以循环利用的物质_______(填化学式)。
(5)如图可知,当液固比(水与矿料的质量比)大于5时,浸出率反而降低的原因________。
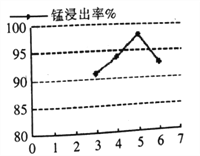
(6)银锰矿中,银矿物以显微粒状分散在MnO2矿物中,不破坏原有结构难以提银,因此锰的浸出对于银的提取率至关重要。某小组通过实验,研究了硫酸用量、黄铁矿用量(占矿重百分比)对锰浸出率的影响,如表所示:
硫酸% | 31.52 | 36.10 | 40.67 | 45.25 |
锰浸出率 | 77.42 | 89.49 | 91.59 | 97.95 |
黄铁矿% | 12.5 | 15 | 17.5 | 20 |
锰浸出率 | 88.79 | 97.95 | 99.18 | 99.46 |
从实际生产角度出发,下表中所给浸出条件最佳的是________。
A | 硫酸45.25% | B | 硫酸31.52% | C | 硫酸45.25% | D | 硫酸36.10% |
黄铁矿20% | 黄铁矿15% | 黄铁矿15% | 黄铁矿20% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com