
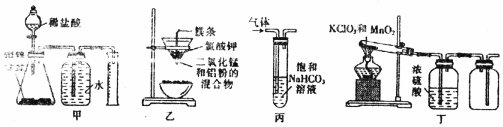
| A. | 装置甲:测定合金中Zn的含量 | B. | 装置乙:制取金属锰 | ||
| C. | 装置丙:洗气除去SO2中的CO2 | D. | 装置丁:实验室制取O2 |
分析 A.排水时甲中导管短进长出;
B.点燃Mg,引发铝热反应,Al与二氧化锰反应生成Mn;
C.二氧化硫与碳酸氢钠反应生成二氧化碳;
D.氧气的密度比空气的密度大,应选向上排空气法收集.
解答 解:A.排水时甲中导管短进长出,排水法收集时导管不合理,不能排出水,故A错误;
B.点燃Mg,引发铝热反应,Al与二氧化锰反应生成Mn,装置乙可制取金属锰,故B正确;
C.二氧化硫与碳酸氢钠反应生成二氧化碳,将原物质除去,不能除杂,故C错误;
D.氧气的密度比空气的密度大,应选向上排空气法收集,收集氧气时长导管进气,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、金属冶炼、气体的收集为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:填空题
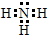 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO和H2 | B. | C6H12O6 | C. | CH2O2 | D. | C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.85gNaCl晶体中含有0.1 NA 个Na+ | |
| B. | 1molFeCl3 完全水解转化为Fe(OH)3胶体后能生成NA个胶体粒子 | |
| C. | 过量的Zn与含1molH2SO4的稀H2SO4完全反应,转移的电子数一定为2NA | |
| D. | 一定量的Fe 与含1molHNO3的稀HNO3恰好完全反应,被还原的氮原子数小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
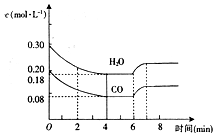 在一固定容积的密闭容器中,进行如下反应:CO+H2O(g)?CO2+H2.其化学平衡常数K与温度T的关系如表:
在一固定容积的密闭容器中,进行如下反应:CO+H2O(g)?CO2+H2.其化学平衡常数K与温度T的关系如表:| T(℃) | 700 | 800 | 850 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


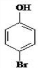 、
、 .
. 是化合物B的一种同分异构体,用1H核磁共振谱可以证明该化合物中有2种氢处于不同的化学环境.
是化合物B的一种同分异构体,用1H核磁共振谱可以证明该化合物中有2种氢处于不同的化学环境.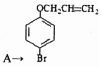 的有机反应类型取代反应.
的有机反应类型取代反应. .
.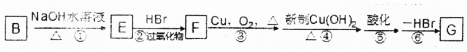
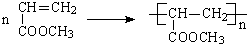 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeBr2溶液中通入过量的Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| B. | 用食醋除去水壶内的水垢:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | KHCO3与足量澄清石灰水反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 在强碱性溶液中,次氯酸钠将Mn2+氧化成MnO2:Mn2++ClO-+H2O═MnO2↓+Cl-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三氧化二铁中有少量的氧化铝:加过量的烧碱溶液后过滤洗涤 | |
| B. | 氯化钠中有少量的I2:通过加热的方法 | |
| C. | CO中有少量的CO2:用氢氧化钠洗涤后再干燥 | |
| D. | 食盐中有少量的氧化铝:加过量的烧碱溶液后蒸发结晶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com