
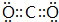
 ,用电子式表示化合物 C2D 的形成过程
,用电子式表示化合物 C2D 的形成过程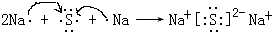 .
. 分析 有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大.已知A和B原子有相同的电子层数,则A、B处于同一周期,且A的L层电子数是K层电子数的两倍,则A有2个电子层,L层电子数为4,故A为碳元素;C单质燃烧时呈现黄色火焰,则C为钠元素;C的单质在点燃时与足量的B单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,则B为氧元素,D为硫元素,据此解答.
解答 解:有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大.已知A和B原子有相同的电子层数,则A、B处于同一周期,且A的L层电子数是K层电子数的两倍,则A有2个电子层,L层电子数为4,故A为碳元素;C单质燃烧时呈现黄色火焰,则C为钠元素;C的单质在点燃时与足量的B单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,则B为氧元素,D为硫元素,
(1)通过以上分析知,A是碳,B是氧,C是钠,D是硫,
故答案为:碳;氧;钠;硫;
(2)CO2分子中碳原子与氧原子形成2对共用电子对,电子式为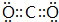 ,故答案为:
,故答案为: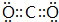 ;
;
(3)D是硫原子,有三个电子层,最外层6个电子,得到硫原子的原子结构示意图为: ,C2D是硫化钠,由钠离子与硫离子构成,硫化钠电子式为
,C2D是硫化钠,由钠离子与硫离子构成,硫化钠电子式为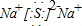 ,用电子式表示其形成过程为:
,用电子式表示其形成过程为: ,
,
故答案为: ;
; .
.
点评 本题考查结构性质位置关系应用,侧重对电子式的考查,注意掌握电子式表示化学键或物质的性质过程,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全球气候变暖可能是由于二氧化碳含量的急剧增加 | |
| B. | 酸雨可以分为硫酸型酸雨和硝酸型酸雨 | |
| C. | 居室中的装潢材料缓慢释放出来的污染物中最常见的是甲醛、苯等有机物蒸气 | |
| D. | 检验居室中甲醛气体是否存在,可以抽取并通过品红溶液来检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

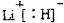 .
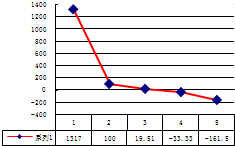
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
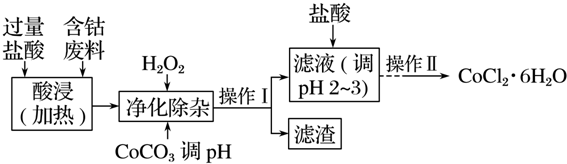
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,4,8 | B. | 2,4,6 | C. | 1,3,6 | D. | 1,3,8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

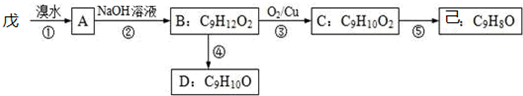
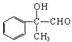
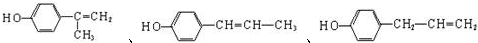 .
.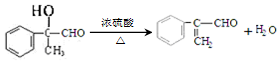 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
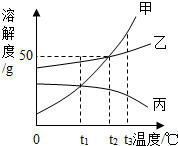
| A. | t1℃时,分别取出相同质量的甲、丙两种饱和溶液升温到t2℃时,甲和乙溶质的质量分数相等 | |
| B. | t2℃时,将甲、乙两种饱和溶液分别恒温蒸发等质量的水,析出晶体的质量可能不等 | |
| C. | 将三种饱和溶液分别从t3℃降低到t2℃时,甲和乙溶质的质量分数减小,丙的溶质的质量分数不变 | |
| D. | 当甲的饱和溶液中含有少量乙时,可以采取冷却热饱和溶液的办法提取乙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com