
| A. | 100mL 2mol/L MgCl2溶液 | B. | 1000mL 2.5 mol/L NaCl溶液 | ||
| C. | 250mL l mol/L AlCl3溶液 | D. | 300mL 3 mol/LKCl溶液 |
分析 Cl-的物质的量浓度与溶质的浓度、溶质的化学式组成有关,与溶液体积大小无关,据此对各选项进行计算与判断.
解答 解:A.100mL 2mol/L MgCl2溶液中,氯离子的浓度为:2mol/L×2=4mo/L;
B.1000mL 2.5 mol/L NaCl溶液中,氯离子的浓度为2.5mol/L;
C.250mL l mol/L AlCl3溶液中氯离子浓度为:1mol/L×3=3mol/L;
D.300mL 3 mol/LKCl溶液中氯离子浓度为3mol/L;
根据分析可知,Cl-的物质的量浓度最大的是A,
故选A.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的表达式与计算方法为解答关键,注意氯离子的浓度与溶液体积大小无关,试题培养了学生的化学计算能力.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入BaCl2溶液,产生白色沉淀,加入HNO3后,白色沉淀不溶解,也无其他现象,说明原溶液中一定含有SO42- | |
| B. | 向某溶液中加盐酸产生无色无味气体,该气体能使澄清的石灰水变浑浊,说明该溶液中一定含有CO32- | |
| C. | 收集氯气时,用湿润的KI淀粉试纸放置于瓶口,观察试纸是否变蓝判断是否收集满 | |
| D. | 某样品的焰色反应呈黄色,则该样品一定是单质钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子总数 | B. | 原子总数 | C. | 质量 | D. | 质子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
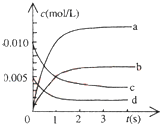 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,33.6L 氯气与27g铝充分反应,转移的电子数目为3NA | |
| B. | 1mol羟基中含有10NA | |
| C. | 1molCH3COONa和少量CH3COOH溶于水所得的中性溶液中,CH3COO-的数目为NA | |
| D. | 1mol O2作氧化剂时转移的电子数目一定为4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com