
| A. | HCO3-+H2O=H2CO3+OH- | |
| B. | HSO3-+H2O?SO32-+H3O+ | |
| C. | 熔融的NaHSO4电离:NaHSO4=Na++HSO4- | |
| D. | Al(OH)3=H++AlO2-+H2O |
分析 A.该式为碳酸氢根离子的水解;
B.亚硫酸氢根离子为弱酸的酸根离子,部分电离出氢离子和亚硫酸酸根离子;
C.硫酸氢钠为强电解质,在熔融状态下完全电离生成钠离子和硫酸氢根离子;
D.氢氧化铝属于两性氢氧化物,有两种电离方式,图示为酸式电离.
解答 解:A.碳酸氢根离子为弱酸的酸根离子,部分电离出氢离子和碳酸根离子,电离方程式为:HCO3-?CO32-+H+,故A错误;
B.H3O+为水合氢离子,亚硫酸氢根离子部分电离出氢离子和亚硫酸酸根离子,电离方程式为:HSO3-+H2O?SO32-+H3O+,故B正确;
C.硫酸氢钠为强电解质,在熔融状态下完全电离生成钠离子和硫酸氢根离子,电离方程式为:NaHSO4=Na++HSO4-,故C正确;
D.氢氧化铝属于两性氢氧化物,有酸式电离和碱式电离两种电离方式,电离方程式为:Al3++3OH-?Al(OH)3?H++AlO2-+H2O,故D正确;
故选A.
点评 本题考查了电离方程式的书写判断,掌握正确书写电离方程式的方法,并会正确判断电离方程式的正误是解题的关键,题目难度不大.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠、盐酸都为强电解质 | |
| B. | 铁生锈、食物腐败都有氧化反应发生 | |
| C. | 糖类、蛋白质都为高分子化合物 | |
| D. | 一氧化碳和二氧化碳都是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①中MnO2和H2SO4都是氧化剂 | B. | 硫酸在该生产中可循环使用 | ||
| C. | ①中析出16gS时转移1mol电子 | D. | ②中MnSO4发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧菜用过的铁锅,经放置常出现红棕色斑迹 | |
| B. | 用煤气灶燃烧沼气(主要成分为甲烷:CH4)为炒菜提供热量 | |
| C. | 铝制容器因长期存放酸性或碱性食物被腐蚀 | |
| D. | 用醋酸除去水垢[主要成分是CaCO3、Mg(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.01×105Pa、25℃时,2.24LCl2中含有的原子数为0.2×6.02×1023 | |
| B. | 0.1L、3mol•L-1NH4NO3溶液中含有的N原子数目为0.3×6.02×1023 | |
| C. | 5.6g铁粉与足量CuSO4溶液反应生成的铜原子数为0.2×6.02×1023 | |
| D. | 46 g NO2和N2O4的混合物中含有的原子数为3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
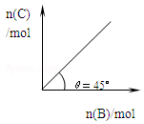 在盛有足量A的体积可变的密闭容器中,保持压强一定,加入B,发生反应:A(s)+2B(g)?4C(g)+D(g);△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变化关系如图.下列说法正确的是
在盛有足量A的体积可变的密闭容器中,保持压强一定,加入B,发生反应:A(s)+2B(g)?4C(g)+D(g);△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变化关系如图.下列说法正确的是| A. | ①③ | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化.实验时必须使用铁屑、4mol•L-1的硫酸溶液,其他试剂任选.填写下列空白.
如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化.实验时必须使用铁屑、4mol•L-1的硫酸溶液,其他试剂任选.填写下列空白.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com