
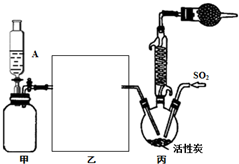
 硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:
硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:分析 根据装置图可知,装置甲为储气装置,用于提供氯气,则仪器A中盛放的试剂要将氯气压入后续反应装置,所以不能溶解氯气,应为饱和食盐水,硫酰氯易水解,所以生成的氯气要干燥,所以乙中应装有浓硫酸干燥氯气,氯气与二氧化硫反应需要用活性碳作催化剂,硫酰氯易水解易挥发,所以在三颈烧瓶上方应连接一个冷凝管和装有碱石灰的干燥管,则甲中活性炭的作用是催化剂,
(1)氯气难溶于饱和食盐水;该反应需要催化剂,则甲中活性炭的作用是催化剂;
(2)装硫酰氯易水解,所以参加反应的氯气需要干燥;
(3)氯磺酸(C1SO3H)加热分解,也能制得硫酰氯与另外一种物质,根据原子守恒可知另一种生成物是硫酸;硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,而硫酸沸点高;
(4)由于硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解;
(5)二氧化硫溶液与氯水都可以漂白品红溶液,若二者恰好完全反应得到盐酸、硫酸,不能使品红溶液褪色.
解答 解:根据装置图可知,装置甲为储气装置,用于提供氯气,则仪器A中盛放的试剂要将氯气压入后续反应装置,所以不能溶解氯气,应为饱和食盐水,硫酰氯易水解,所以生成的氯气要干燥,所以乙中应装有浓硫酸干燥氯气,氯气与二氧化硫反应需要用活性碳作催化剂,硫酰氯易水解易挥发,所以在三颈烧瓶上方应连接一个冷凝管和装有碱石灰的干燥管,则甲中活性炭的作用是催化剂,
(1)根据上面的分析可知,仪器A中盛放的试剂为 饱和食盐水,装置丙中活性炭的作用是催化剂,故答案为:饱和食盐水;催化剂;
(2)根据上面的分析可知,在如图方框内画出所缺装置为浓硫酸干燥氯气的装置,装置图为 ,故答案为:
,故答案为: ;
;
(3)氯磺酸(C1SO3H)加热分解,也能制得硫酰氯与另外一种物质,根据原子守恒可知另一种生成物是硫酸,因此该反应的化学方程式为2C1SO3H$\frac{\underline{\;\;△\;\;}}{\;}$SO2Cl2+H2SO4;硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,而硫酸沸点高,则分离产物的方法是蒸馏,答案选C,
故答案为:2C1SO3H$\frac{\underline{\;\;△\;\;}}{\;}$SO2Cl2+H2SO4;C;
(4)由于硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解,因此为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有①先通冷凝水,再通气,②控制气流速率,宜慢不宜快,③若三颈烧瓶发烫,可适当降温,但不能加热三颈烧瓶,否则会加速分解,
故答案为:①②③;
(5)二氧化硫溶液与氯水都可以漂白品红溶液,若二者恰好完全反应得到盐酸、硫酸,不能使品红溶液褪色,检验方案为:取少量溶液,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应,否则,二者未完全反应,
故答案为:取少量溶液,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应,否则,二者未完全反应.
点评 本题考查实验制备方案,涉及对反应原理、装置及操作的分析评价、对仪器的识别、物质的分离提纯等,注意对物质性质信息的应用,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Al>Mg>Na | B. | 热稳定性:HF>H2O>NH3 | ||
| C. | 酸性:HClO4>H2SO4>H2PO4 | D. | 金属性:Na>Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铝可以与氢氧化钠溶液反应 | |
| B. | 向硅酸钠溶液中滴加适量稀盐酸,有透明的凝胶形成 | |
| C. | 氯气通入石蕊中先变红后褪色 | |
| D. | 向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ②③ | C. | ③⑤ | D. | ②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有的金属都是固态的 | |
| B. | 金属具有导电性、导热性和延展性 | |
| C. | 金属都能与酸反应,但不能与碱反应 | |
| D. | 金属元素在自然界中都是以化合态存在的 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com