
分析 (1)n(CuCl2)=$\frac{m}{M}$=$\frac{135g×10%}{135g/mol}$;
(2)根据c(CuCl2)=$\frac{n}{V}$及氯离子和氯化铜的关系式计算氯离子物质的量浓度.
解答 解:(1)n(CuCl2)=$\frac{m}{M}$=$\frac{135g×10%}{135g/mol}$=0.1mol,
答:氯化铜的物质的量是0.1mol;
(2)c(CuCl2)=$\frac{n}{V}$=$\frac{0.1mol}{0.1L}$=1mol/L,根据原子守恒得c(Cl-)=2c(CuCl2)=2×1mol/L=2mol/L,
答:氯离子的物质的量浓度是2mol/L.
点评 本题考查物质的量有关计算,为高频考点,侧重考查学生计算能力,明确各个物理量关系是解本题关键,题目难度不大.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 铜、铁和FeCl3溶液形成的原电池,铜极放出氢气 | |
| B. | 电解硫酸钠溶液就是电解水,电解后溶液pH升高 | |
| C. | 铁锅生锈的正极反应为:O2+2H2O+4e-═4OH- | |
| D. | 工业上电解饱和食盐水的阳极反应为:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁是一种银白色固体 | |
| B. | 镁是热和电的良导体 | |
| C. | 镁在自然界中主要以单质的形式存在 | |
| D. | 镁常温下能与氧气反应,生成一层致密的氧化薄膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3+6HCl=2AlCl3+3H2O | |
| B. | 2Al+6HCl=2AlCl3+3H2↑ | |
| C. | Al(OH)3+3HCl=AlCl3+3H2O | |
| D. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | CN- 浓度 | 加入救援废水中的K2FeO4 | ||
| 救援废水 | 残余 | 浓度 | 利用率 | |
| ① | 10mg/L | 0.082mg/L | 75mg/L | 67.14% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
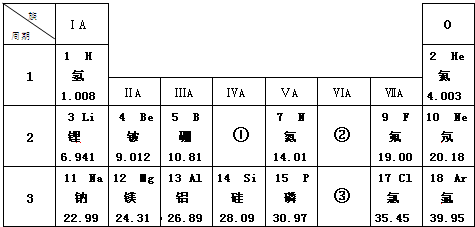
 ,它在表中位置是③.(填“①”、“②”或“③”)该原子的最外层电子数为6
,它在表中位置是③.(填“①”、“②”或“③”)该原子的最外层电子数为6查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com