
| A. | 溶于水时,HI分子比HCl分子更容易电离 | |
| B. | HI比HCl熔、沸点都高 | |
| C. | HI比HCl更稳定 | |
| D. | 拆开相同物质的量的HI分子比HCl消耗的能量小,HI是离子化合物 |
分析 化学键的键能越大,化学键越稳定,越不易发生电离、不易发生分解反应,据此分析解答.
解答 解:化学键的键能越大,化学键越稳定,越不易发生电离、不易发生分解反应,H-Cl的键能大于H-I,说明HCl的稳定性大于HI,
A.键能越小越容易发生电离,H-Cl的键能大于H-I,所以HI分子比HCl更容易电离,故A正确;
B.氢化物都是分子晶体,熔沸点与其相对分子质量成正比,与化学键强弱无关,故B错误;
C.键能越大,物质越稳定,越不容易分解,HCl的键能大于HI,所以HCl比HI稳定,故C错误;
D.键能越大,拆开相同物质的量的物质时消耗能量越多,拆开相同物质的量的HI分子比HCl消耗的能量小,HI中只存在共价键,为共价化合物,故D错误;
故选A.
点评 本题考查键能的有关知识,明确键能与物质稳定性关系是解本题关键,注意:化学键影响物质化学性质,分子晶体中相对分子质量影响物质熔沸点,易错选项是B.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:解答题
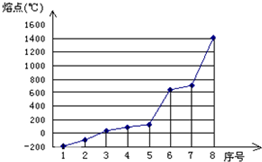 人们生产、生活和科研中离不开材料,下面是与材料有关的题目,请解答:
人们生产、生活和科研中离不开材料,下面是与材料有关的题目,请解答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知反应:2NO2(g)?N2O4(g),△H<0,为了探究温度对化学平衡的影响,有人做了如图实验:把NO2和N2O4的混合气体通入甲、乙两个连通的烧瓶里,然后用夹子夹住橡皮管,把两烧瓶分别浸入两个分别盛有500mL 6mol/L的HCl溶液和盛有500mL蒸馏水的烧杯中(两烧杯中溶液的温度相同).
已知反应:2NO2(g)?N2O4(g),△H<0,为了探究温度对化学平衡的影响,有人做了如图实验:把NO2和N2O4的混合气体通入甲、乙两个连通的烧瓶里,然后用夹子夹住橡皮管,把两烧瓶分别浸入两个分别盛有500mL 6mol/L的HCl溶液和盛有500mL蒸馏水的烧杯中(两烧杯中溶液的温度相同).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | FeBr2溶液中通入少量Cl2:Fe2++Cl2═Fe3++2Cl- | |
| B. | 金属钠跟水反应2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 碳酸钡溶于醋酸BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 向NH4HSO4溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (A-x+n)mol | B. | (A-x-n)mol | C. | (A-x+n)n/Amol | D. | (A-x-n)n/Amol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将一定质量的Mg和Al的混合物投入2.0mol/L,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入一定浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示.回答下列问题:
将一定质量的Mg和Al的混合物投入2.0mol/L,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入一定浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 与金属钠作用时,键①断 | |
| B. | 燃烧时,①②③④⑤键均断裂 | |
| C. | 和乙酸、浓硫酸共热时,键②断裂 | |
| D. | 在银催化下和氧气反应时,键①和③断裂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com