
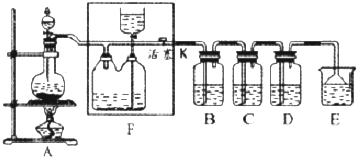
分析 (1)浓盐酸与二氧化锰在加热条件下反应生成氯化锰、氯气与水;
(2)可以储存氯气、起安全瓶作用,防止后续装置发生堵塞时装置爆炸;
(3)B中发生反应:2KI+Cl2═I2+2KCl,碘与淀粉变蓝色,氯气充满上部空间,C中氯气与水反应生成HCl与HClO,溶液呈酸性,且HClO具有漂白性;
(4)氯气与氯化亚铁反应生成氯化铁;
(5)四氯化碳萃取氯水中的氯气,有机层在下层且为黄绿色,上层溶液中含有HClO,可以漂白有色布条.
解答 解:(1)浓盐酸与二氧化锰在加热条件下反应生成氯化锰、氯气与水,反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)可以储存氯气、起安全瓶作用,防止后续装置发生堵塞时装置爆炸,应盛放饱和食盐水,可以降低氯气溶解度,
故答案为:储存氯气、起安全瓶作用,防止后续装置发生堵塞时装置爆炸;饱和食盐水;
(3)B中发生反应:2KI+Cl2═I2+2KCl,溶液变蓝色,上部空间由无色变为黄绿色;C中氯气与水反应生成HCl与HClO,溶液呈酸性,且HClO具有漂白性,溶液先变红色后褪色,上部空间由无色变为黄绿色,
故答案为:B中上部空间由无色变为黄绿色,溶液变蓝色;C中上部空间由无色变为黄绿色,溶液先变红色后褪色;
(4)氯气与氯化亚铁反应生成氯化铁,反应方程式为:2FeCl2+Cl2═2FeCl3,
故答案为:2FeCl2+Cl2═2FeCl3;
(5)四氯化碳萃取氯水中的氯气,有机层在下层且为黄绿色,上层溶液中含有HClO,可以使有色布条褪色,
故答案为:下层液;上层液.
点评 本题综合考查氯气制备与性质实验,涉及实验原理、对装置的分析与评价、萃取等,侧重于学生的分析能力、实验能力的考查,难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液中溶质微粒一定不带电,胶体中分解质微粒带有电荷 | |
| B. | 溶液呈电中性,胶体带电荷 | |
| C. | 胶体是比溶液更稳定的分散系 | |
| D. | 胶体是一种较稳定的分散系 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线 | |
| B. | 容量瓶用蒸馏水洗净后,再用待配溶液润洗 | |
| C. | 配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线 | |
| D. | 使用容量瓶前检查它是否漏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
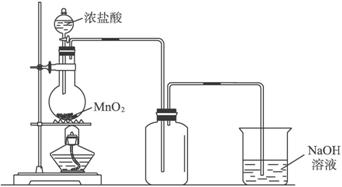

| 溶液A | 固体B | 气体C | |
| a | 稀硫酸 | Zn | Cl2 |
| b | 浓盐酸 | MnO2 | H2 |
| c | 稀硝酸 | Fe | Cl2 |
| d | 浓盐酸 | KMnO4 | H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分类标准 | 电解质 | 盐 | 非电解质 | 混合物 |
| 属于该类 的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1=Q2=Q3 | B. | Q2>Q1>Q3 | C. | Q2>Q3>Q1 | D. | Q2=Q3>Q1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com