
 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 水中溶解性 | |
| 乙酸 | 60 | 1.051 | 118.0 | 溶 | |
| 环己醇 | 100 | 0.982 | 160.8 | 微溶 | |
| 乙酸环己酯 | 142 | 0.969 | 173.5 | 难溶 |
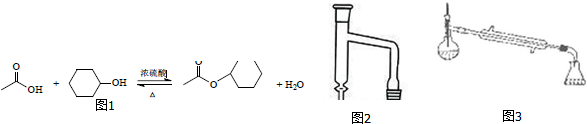
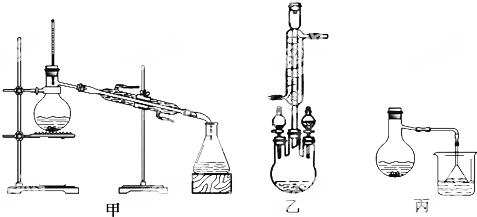
分析 (1)根据装置中仪器的使用方法判断;
(2)酯化反应是可逆反应,增加一种反应物的物质的量可以提高另一种反应物的转化率;
(3)减少生成的物质的量可以提高反应物的转化率;
(4)反应液中有硫酸、醋酸等酸性物质,可以与碳酸氢钠反应,再用水除去碳酸氢钠;无水MgSO4的具有吸水性;
(5)根据产率=$\frac{实际产量}{理论产量}$×100%进行计算;
(6)环己醇的沸点比乙酸环己酯低,若采用如图3装置,产品中有未反应的环己醇.
解答 解:(1)冷凝管使用时,冷凝水应从下口进上口出,
故答案为:冷凝水应从下口进上口出;
(2)酯化反应是可逆反应,增加一种反应物的物质的量可以提高另一种反应物的转化率,所以增加乙酸的量可以提高环已醇的转化率,
故答案为:提高环已醇的转化率;
(3)在制乙酸环己酯的反应中,水是生成物,将生成的水及时从体系中分离出来,提高反应物的转化率,
故答案为:将生成的水及时从体系中分离出来,提高反应物的转化率;
(4)反应混合液中有硫酸、醋酸等酸性物质,可以与碳酸氢钠反应,所以可以用再用碳酸氢钠洗去硫酸和醋酸,再用水可以洗去碳酸氢钠,无水MgSO4的具有吸水性,所以用,无水MgSO4干燥产品,
故答案为:洗去硫酸和醋酸;洗去碳酸氢钠;干燥;
(5)0.2mol乙酸和0.1mol环己醇反应,理论上可以生成0.1mol乙酸环己酯,即14.2g,而实际产量是6.9g,所以本次实验的产率=$\frac{实际产量}{理论产量}$×100%=$\frac{6.9g}{14.2g}$×100%=48.6%,
故答案为:48.6%;
(6)环己醇的沸点比乙酸环己酯低,若采用如图3装置,产品中有未反应的环己醇,所以会使实验的产率偏高,
故答案为:偏高;产品中会收集到未反应的环己醇.
点评 考查了常见仪器的构造与安装、混合物的分离、提纯、物质的制取、药品的选择及使用、物质产率的计算等知识,题目难度中等,试题涉及的题量较大,知识点较多,充分培养了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 28 g氮气含有的原子数为NA | |
| B. | 4g金属钙的物质的量为1mol | |
| C. | 1 mol O2分子的质量等于1 mol氧原子的质量 | |
| D. | 24 g O2分子和24 g O3分子所含的氧原子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
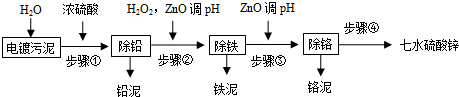
| 离子 | Fe2+ | Fe3+ | Cr3+ | Zn2+ |
| 开始沉淀的pH值 | 5.9 | 2.3 | 3.9 | 5.7 |
| 完全沉淀的pH值 | 8.3 | 3.2 | 5.6 | 8.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
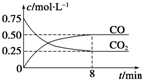 某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:
某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:| 温度/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 )为原料,制取苯甲酸甲酯.已知有关物质的沸点如表:
)为原料,制取苯甲酸甲酯.已知有关物质的沸点如表:| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
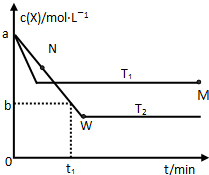 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在N2+3H2?2NH3的平衡体系中,缩小体积,平衡向右移动,氨的产率增加 | |
| B. | 在CH3COOH?CH3COO-+H+的平衡体系中加入CH3COONa固体,平衡向左移动 | |
| C. | 在H2S?H++HS-的平衡体系升温到100℃时,溶液中的c(H+)一定增大 | |
| D. | 在盐酸中加入KCl晶体,溶液pH不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com