
【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到的滤液用 NaHCO3溶液处理,测得溶液pH、n[Al(OH)3]随加入NaHCO3溶液体积变化的曲线如下图所示。下列有关说法不正确的是
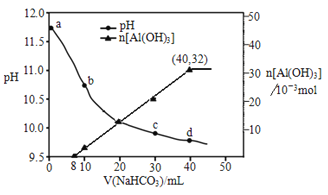
A. 生成沉淀的离子方程式为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
B. b 点与c点溶液所含微粒种类相同
C. a 点溶液中大量存在的离子是Na+、AlO2-、OH-
D. NaHCO3溶液的物质的量浓度为0.8mol/L
【答案】D
【解析】
氧化铝和氢氧化钠反应,而氧化铁不反应,过滤后得到滤液用碳酸氢钠处理,发生HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-,加入40毫升碳酸氢钠溶液时沉淀最多,a、b、c点都为碱性,随着碳酸氢钠的加入,碱性减弱,以此解答。
A.偏铝酸根离子促进碳酸氢根电离,生成沉淀的离子方程式为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-,故正确;B. b 点与c点溶液所含微粒种类相同,均为钠离子、偏铝酸根离子、氢氧根离子、碳酸根离子,故正确;C. a 点溶液显碱性,溶质为氢氧化钠和偏铝酸钠,存在的离子是Na+、AlO2-、OH-,故正确;D. 加入40毫升碳酸氢钠的溶液时沉淀最多,沉淀为0.032mol,氢氧化钠过量,滤液中含有氢氧化钠,由于氢氧根离子和碳酸氢根离子反应生成碳酸根离子和水,HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-可知,前8毫升不生成沉淀,NaHCO3溶液的物质的量浓度为0.032/0.032=1.0mol/L,故错误。故选D。


科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液 200mL,平均分成两份。向其中一份中逐渐加入铜粉, 最多能溶解 l9.2g(已知硝酸只被还原为 NO 气体,下同)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列说法不正确的是( )

A. c 点时,溶液中的溶质为 FeSO4
B. oa 段发生反应的化学方程式为:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O
C. 原混和酸中稀硝酸的物质的量浓度为 2mol/L
D. 原混和酸中稀硫酸的物质的量浓度为 4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲为在铜棒上电镀银的装置,图乙是在图甲装置中央放置质量相等的两个银圈,用绳子系住(绳子为绝缘体),一段时间后,两装置中铜极质量均增重1.08g。下列说法不正确的是
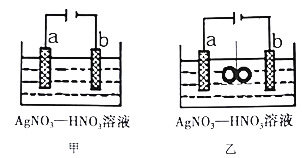
A. 电极a为纯银
B. 图甲:若b极有标况下112mL红棕色气体生成,则电子有效利用率为50%
C. 图乙:若乙池中无气体生成,则绳子两端银圈质量之差为2.16g
D. 处理银器表面的黑班(Ag2S),将银器置于盛有食盐水的铝制容器里并与铝接触,则Ag2S可以转化为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列热化学方程式
C(s) + O2(g) = CO2(g) △H1=–393.5 kJ·mol-1
2H2(g) + O2(g) =2H2O(l) △H2=–571.6 kJ·mol-1
CH3COOH(l) +2O2(g)=2CO2 (g) + 2H2O(l) △H3=–870.3 kJ·mol-1
可以计算出2C(s) + 2H2(g)+ O2(g)=CH3COOH(l)的反应热为:
A. △H=+244.1 kJ·mol-1B. △H=-488.3 kJ·mol-1
C. △H=-996.6 kJ·mol-1D. △H=+996.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某100 mL混合酸溶液中,HNO3和H2SO4的物质的量浓度分别为0.2 mol·L-1和0.4 mol·L-1,向该混合溶液中加入2.24 g铁粉,加热充分反应后,下列说法不正确的是
A. 生成的气体在标准状况下的体积为672 mLB. 生成的气体有NO和H2
C. 所得溶液中有溶质FeSO4和Fe2(SO4)3D. 所得溶液中Fe2+的物质的量浓度为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,A的简单离子半径是同周期元素简单离子中半径最小的。请回答下列问题:

(1)描述D在元素周期表中的位置:_____________________________。
(2)在A、B、C、E四种元素最高价氧化物对应的水化物中酸性最强的是__________(写化学式,下同),非金属最简单气态氢化物最不稳定的是_____________________。
(3)写出满足下列条件分子的结构式_________________________
①所有原子最外层是8个电子; ②C和E组成的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学一选修5:有机化学基础)有机物H是一种中枢神经兴奋剂,其合成路线如下图所示。
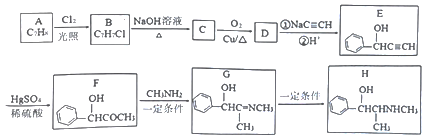
请回答下列问题:
(1)A的化学名称为______,C的结构简式为________。
(2)E中官能团的名称为______。B→C、G→H的反应类型分别为____、______。
(3)D分子中最多有___个原子共平面。
(4)F→G历经两步反应,第一步反应的化学方程式为_______。
(5)同时满足下列条件的F的同分异构体有___种(不考虑立体异构)。
①能发生银镜反应; ②能与氯化铁溶液反应; ③分子中只有1个甲基。
其中核磁共振氢谱有6组峰的结构简式为___________。
(6)最近网上流传,某明星的天价童颜针,其主要成分为聚乳酸,结构简式为 ,它是具有填充、紧致、提拉多重效果的微整形新武器,且具有生理兼容性与可降解性,比传统的硅胶填充整容要先进。参照上述合成路线,以丙烯为原料制备
,它是具有填充、紧致、提拉多重效果的微整形新武器,且具有生理兼容性与可降解性,比传统的硅胶填充整容要先进。参照上述合成路线,以丙烯为原料制备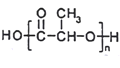 的合成路线流程图(无机试剂任选)____________________。
的合成路线流程图(无机试剂任选)____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的NaOH和HCl物质的量之比为( )
A. 3: 1 B. 2:1 C. 1:1 D. 1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含 卤 族 元 素 的 化 合 物 在 科 研 和 生 产 中 有 许 多 重 要 用 途 。 如 : 2 m o l S b ( C H 3 ) 3 、 2 m o lSb(CH3)2Br 和 2molSb(CH3)Br2 进行重组反应可生成空间位阻最小的离子化合物:[Sb2(CH3)5]2 [Sb2(CH3)2Br6],已知 Sb 与 N 同主族。请回答:
(1) 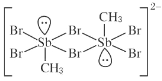 中,H、C、Br 的电负性由小到大的顺序为_____,溴原子的价电子排布式 为_____。
中,H、C、Br 的电负性由小到大的顺序为_____,溴原子的价电子排布式 为_____。
(2)[Sb2(CH3)5] +的结构式为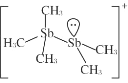 ,Sb 原子的杂化轨道类型为_____。写出一种与CH3 -互为等电子体的分子_____。
,Sb 原子的杂化轨道类型为_____。写出一种与CH3 -互为等电子体的分子_____。
(3)X 射线衍射测定等发现,I3AsF6 中存在 I3+ 离子。I3+ 离子的几何构型为_____。
(4)一定条件下 SbCl3 与 GaCl3 以物质的量之比为 l:l 混合得到一种固态离子化合物,其结构组成可能 为:(a) [GaCl2+ ][SbCl4- ]或(b) [SbCl2+ ][GaCl4- ],该离子化合物最可能的结构组成为_____ (填“a”或“b”),理由是_____。
(5)固态 PCl5 结构中存在 PCl4+ 和 PCl6 -两种离子,其晶胞如图所示。
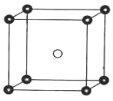
已知晶胞的边长为 a pm ,阿伏加德罗常数值用 NA表示。则 PCl4+ 和 PCl6 - 之间的最短距离为_____pm,固态 PCl5 的密度为_____gcm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com