
| A. | 78克苯中含有碳碳双键的数目为3NA | |
| B. | 1molCl2与足量的铁反应,转移的电子数为3NA | |
| C. | 标准状况下,2.24LCCl4所含分子数为0.1NA | |
| D. | 0.2mol金属钠与足量的O2反应,产物中离子数为0.3 NA |
分析 A.苯分子中的碳碳键为介于单键和双键之间的独特键,不存在碳碳双键;
B.1mol氯气与铁完全反应最多得到2mol电子;
C.标准状况下,四氯化碳的状态不是气体;
D.0.1mol钠完全反应生成0.1mo过氧化钠,0.1mol过氧化钠中含有0.2mol钠离子和0.1mol过氧根离子.
解答 解:A.苯分子中的碳碳键为一种独特键,不存在碳碳双键,故A错误;
B.1molCl2与足量的铁反应,氯气最多得到2mol电子,则转移的电子数为2NA,故B错误;
C.标准状况下四氯化碳不是气体,不能使用标准状况下的气体摩尔体积计算,故C错误;
D.0.2mol金属钠与足量的O2反应生成0.1mol过氧化钠,0.1mol过氧化钠中含有0.2mol钠离子和0.1mol过氧根离子,产物中总共含有0.3mol离子,含有的离子数为0.3NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意明确标准状况下气体摩尔体积的使用条件,熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{r(Ca)}{r(Mg)}$ | B. | $\frac{r(C{l}^{-})}{r(A{l}^{3+})}$ | C. | $\frac{r(Na)}{r(Mg)}$ | D. | $\frac{r(N{a}^{+})}{r({F}^{-})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(g)△H=+483.6 kJ/mol | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ/mol | |
| D. | 己知2C(s)+2O2(g)═2CO2(g)△H1 2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠保存在煤油中 | |
| B. | 工业上金属Mg、Al都是用电解熔融的氯化物制得的 | |
| C. | 合金的硬度一般比各成分金属大 | |
| D. | 铜与氯化铁溶液的反应常用于制作印刷电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水,浓H2SO4 | B. | 溴水,浓H2SO4 | ||
| C. | 无水硫酸铜,浓H2SO4 | D. | 浓H2SO4,酸性高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠属于危化品中的易燃固体,其着火时不能用水灭火 | |
| B. | 氰化钠( NaCN)是一种剧毒危险品,其水溶液呈碱性 | |
| C. | 实验室里可将少量的钠保存于煤油中 | |
| D. | NH4N03、NaCN、CaC2中均含有离子键和非极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
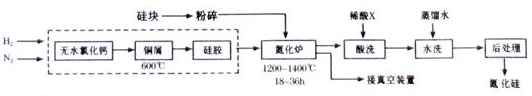
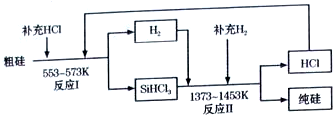
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol羟基(-OH)中所含共价键数 | |
| B. | 1molHCl与KClO3反应生成0.5molCl2转移的电子数 | |
| C. | 1.8 g H2O中所含有的质子数、电子数、中子数 | |
| D. | 常温常压下,22.4LNO和CO混合气体中的O原子个数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 事实 | 结论 | |
| A | HClO与H2SO3反应生成H2SO4和HCl | 非金属性:Cl>S |
| B | N2比白磷稳定得多 | 非金属性:P>N |
| C | 在约800℃时,金属钠可从熔融的KCl中置换出K | 金属性:Na>K |
| D | 工业上电解Na2AlF6和Al2O3的熔融混合物得到Al | 金属活动性:Na>Al |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com