
【题目】X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R同周期,R与Y同主族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
A.简单氢化物的熔沸点:Y<RB.简单离子半径:R>Y>Z>W
C.X2Y2和Z2Y2均为含有非极性键的离子化合物D.常温下,W的单质与R的最高价含氧酸的浓溶液不发生反应
【答案】B
【解析】
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大,X是周期表中原子半径最小的元素,则X为H元素;Y原子最外层电子数是次外层电子数的3倍,Y原子有2个电子层,最外层电子数为6,故Y为O元素;R与Y处于同一族,则R为S元素;Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,则Z、W原子的核外电子数之和为8+16=24,而Z、W、R处于同一周期,应为第三周期,原子序数W大于Z,故Z为Na,W为Al元素,X、Y、Z、W、R分别是H、O、Na、Al、S,据此解答。
A.Y为O元素,R为S元素,氧元素的氢化物是水,硫元素的氢化物是硫化氢,水分子间含有氢键,硫化氢分子间含有范德华力,氢键的作用力强于范德华力,故简单氢化物的熔沸点:水大于硫化氢,即Y>R,故A错误;
B.Y、Z、W、R分别是O、Na、Al、S,简单离子分别为:O2-、Na+、Al3+、S2-,S2-含有三层电子,O2-、Na+、Al3+含有两层电子,核外电子层数越多,半径越大;电子层数相同时,核电荷数越大,半径越小,简单离子半径:R>Y>Z>W,故B正确;
C.X为H元素,Y 是O元素,Z 是Na,X2Y2是H2O2,是含有极性键和非极性键的共价化合物,Z2Y2是过氧化钠,是含有非极性键的离子化合物,故C错误;
D.常温下,Al的单质与S的最高价含氧酸的浓溶液发生钝化,不是不发生反应,故D错误;
答案选B。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】有a、b、c、d四种金属,将a与b用导线连结起来浸入电解质溶液中,b不易腐蚀。将a、d分别投入等浓度的盐酸中,d比a反应剧烈。将Cu浸入b的盐溶液里,无明显变化。如果把Cu浸入c的盐溶液里,有c的单质析出。据此判断它们的活动性由强到弱的顺序是
A.d、c、a、bB.d、b、a、cC.d、a、b、cD.b、a、d、c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铜混合粉末18.0g加入到100 mL 5.0 mol·L-1FeCl3溶液中,充分反应后,剩余固体质量为2.8g。
求:(1)原固体混合物中铜的质量是__________g ;
(2)反应后溶液中n(Fe2+)+ n(Cu2+)=________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 为阿伏伽德罗常数的值。下列叙述正确的是( )
A.1.0L 1.0mol·L-1 的 NaAlO2 水溶液中含有的氧原子数为 2NA
B.28g 聚乙烯中含有碳碳双键的个数为 1NA
C.标况下,含 0.5 NA 个氖原子的氖气占有的体积约为 11.2L
D.1 mol 的羟基与 1 mol 的氢氧根离子所含电子数均为 9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017 年诺贝尔生理学或医学奖授予3位美国科学家Jffrey C. Hall, Michael Rosbash 和Michael w. Young以表彰他们发现了调控"生物钟”的分子机制。褪黑素(C13H16N2O2)是一种生物钟调节剂。请问褪黑素属于
A.氧化物B.无机物C.有机物D.烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对相应有机物的描述完全正确的是( )
①甲烷:与氯气在光照条件下反应生成的CH2Cl2有两种结构
②乙烯:可发生加成反应和加聚反应,其产量可以用来衡量一个国家石油化工发展水平
③苯:12个原子共平面,1mol苯中含有3mol碳碳双键
④乙醇:常温下具有特殊香味的液体,常用作调味品,也可以用来杀菌消毒
⑤油脂:属于酯类,在碱性条件下发生水解反应生成甘油和高级脂肪酸,称为皂化反应
⑥蔗糖:糖尿病人尿液的成分之一,可以用新制Cu(OH)2检验
⑦蛋白质:水解的最终产物为氨基酸,部分蛋白质遇浓硝酸显黄色
A.②④⑤⑦B.②④⑦C.①②③⑤⑥⑦D.②④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝-空气-海水为能源的电池为我国首创,该电池用于航海标志灯,只要把灯放入海水中数秒钟,就会发出耀眼的白光。电极材料为Al与石墨。该电池工作时,下列说法正确的是
A.铝电极是该电池的正极B.海水中Cl-向石墨电极移动
C.石墨电极的反应:O2+2H2O+4e-=4OH-D.该新型电池属于二次电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下面是我们熟悉的物质:
①O2 ②SO2 ③CaCl2 ④HNO3 ⑤NaOH ⑥NH4Cl
这些物质中,属于共价化合物的是 ___________;属于离子化合物的是___________;只含离子键的是___________。
(2)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。

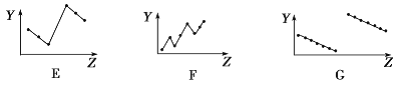
把与下面的元素有关性质相符的曲线的标号填入相应括号中:
①第ⅡA族元素的最外层电子数________________。
②第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径________________。
③第二、三周期主族元素随原子序数递增原子半径的变化____________。
(3)已知某单核粒子的结构示意图为:![]()
①当x-y=10时,该粒子为____________(填“原子”、“阳离子”或“阴离子”)。
②当y=8时,若该微粒的氧化性很弱,得一个电子后变为原子,该微粒的符号是_____。
(4)已知A、B、C、D是中学化学中常见的四种10电子微粒,它们之间存在如图中转化关系。

请写出:A的化学式 (写一种); D的化学式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修2:化学与技术】联合生产是实现节能减排的重要措施,工业上合成氨和硝酸的联合生产具有重要意义。下面是工业上合成氨的简易流程:


(1)设备A内部结构如右下图所示,其名称是________ ,其中发生的化学反应方程式为_________;生产中原料气必须进行脱硫,目的是____________。选择500℃进行反应的主要原因是___________;
(2)设备B的名称是冷凝塔,图中a和b是两个通水口,其中入水口是 (填“a”或“b”)。
(3)氮气和氢气的混合气体通过压缩机压缩的原因是________________________________。
(4)生产出来的NH3可以用来生产硝酸。其中在氨气催化氧化过程中,不同温度下生成产物可能有所不同,温度对氨氧化产物产率的影响如下图所示;当温度大于900℃时,NO的产率下降的主要原因是__________________。

(5)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是94%,NO制HNO3的产率是89%,则制HNO3所用NH3的质量占总耗NH3质量(不考虑其它损耗)的 %(保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com