
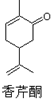
| A. | 香芹酮化学式为C10H14O | |
| B. | 香芹酮可以发生加成反应、消去反应和氧化反应 | |
| C. | 香芹酮能使酸性KMnO4溶液褪色 | |
| D. | 香芹酮分子中有3种官能团 |
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的液化是物理变化 | |
| B. | 石油干馏可得到汽油、煤油等 | |
| C. | 淀粉、蛋白质完全水解的产物互为同分异构体 | |
| D. | 乙酸乙酯、油脂与NaOH溶液反应均有醇生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氯乙烷中直接加入AgNO3溶液 | |
| B. | 加蒸馏水,然后加入AgNO3溶液 | |
| C. | 加入NaOH溶液,加热后酸化,然后加入AgNO3溶液 | |
| D. | 加入NaOH的乙醇溶液,然后加入AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>H2SO4>H3PO4 | B. | 稳定性:HBr>HCl>HF | ||
| C. | 原子半径:r(Si)>r(N)>r(O) | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
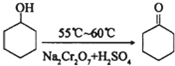
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3、20℃) | 溶解性 |
| 环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
| 环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
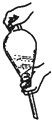
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和镁分别与冷水反应,判断金属活动性强弱 | |
| B. | 铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱 | |
| C. | 酸性H2CO3<H2SO4,判断硫与碳的非金属活动性强弱 | |
| D. | Br2与I2分别与足量的H2反应,判断溴与碘的非金属活动性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com