
【题目】海洋是一个丰富的资宝库,通过海水的综合利用可获得许多物质供人类使用.
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为t,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩.所建盐田分为贮水池、蒸发池和池.
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用:(写一点即可).
(2)电渗析法是近年发展起的一种较好的海水淡化技术,其原理如图所示.其中具有选择性的阴离子交换膜和阳离子交换膜相间排列.请回答下面的问题:
①海水不能直接通人到阴极室中,理由是 .
②A口排出的是(填“淡水”或“浓水”)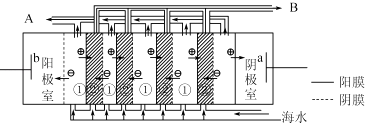
(3)用苦卤(含Na+、K+、Mg2+、Cl﹣、Br﹣等离子)可提取溴,其生产流程如下 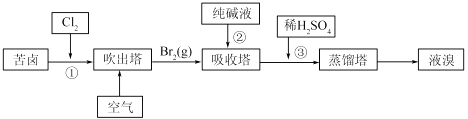
①若吸收塔中的溶液含BrO3﹣ , 则吸收塔中反应的离子方程式为:
②通过①氯化已获得含Br2的溶液.为何还需经过吹出、吸收、酸化重新获得含Br2的溶液? .
③向蒸馏塔中通入水蒸气加热.控制温度在90℃左右进行蒸馏的原因是 .
【答案】
(1)结晶;阻止H2与Cl2发生反应甚至发生爆炸或阻止Cl2与生成的NaOH溶液反应而使烧碱产品不纯等
(2)海水中含较多Mg2+和Ca2+等阳离子,电解时会产生Mg(OH)2、Ca(OH)2等沉淀从而堵塞阳离子交换膜;淡水
(3)3CO32﹣+3Br2=5Br﹣+BrO3﹣+3CO2↑;富集溴,提高Br2的浓度;温度过低难以将Br2蒸馏出来,但温度过高又会将大量的水蒸馏出来
【解析】解:(1)①海水晒盐需要通过蒸发、结晶过程,所以还需要结晶池,
所以答案是:结晶;
②阳离子交换膜只能阳离子通过,阴离子和气体不能通过,用石墨作电解电解饱和氯化钠时,阳极上氯离子放电生成氯气,氯气不能通过阳离子交换膜而进入阴极,如果氯气进入阴极易和氢气混合产生爆炸,且易和氢氧化钠溶液反应生成氯化钠、次氯酸钠而导致制取的氢氧化钠不纯,
所以答案是:阻止H2与Cl2发生反应甚至发生爆炸或阻止Cl2与生成的NaOH溶液反应而使烧碱产品不纯等;(2)①海水中含有海水中含较多Mg2+和Ca2+等阳离子,电解时阴极附近生成氢氧根离子,导致氢氧根离子和钙镁离子反应生成Mg(OH)2、Ca(OH)2等沉淀从而堵塞阳离子交换膜,从而抑制离子通过,导致电渗析法失败,
所以答案是:海水中含较多Mg2+和Ca2+等阳离子,电解时会产生Mg(OH)2、Ca(OH)2等沉淀从而堵塞阳离子交换膜;
②在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,①室离子浓度变小,②室离子浓度不大,离子浓度大的为浓水,所以浓水在B处排出,淡水在A处排出,
所以答案是:淡水;(3)①纯碱是碳酸钠,与溴反应有BrO3﹣生成,反应的离子方程式为:3CO32﹣+3Br2=5Br﹣+BrO3﹣+3CO2↑,
所以答案是:3CO32﹣+3Br2=5Br﹣+BrO3﹣+3CO2↑;②从①出来的溶液中溴的含量不高,如果直接蒸馏,产品成本高,所以需要进一步浓缩溴,提高溴的浓度,
所以答案是:富集溴,提高Br2的浓度;③温度过高水蒸气蒸出,溴中含有水分,温度过低溴不能完全蒸出,产率低,
所以答案是:温度过低难以将Br2蒸发出来,但温度过高又会将大量的水蒸馏出来.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】25 ℃时,用0.1000 mol·L-1NaOH溶液滴定20. 00 mL 0.1000 mol·L-1CH3COOH溶液,所得滴定曲线如右图。下列说法正确的是
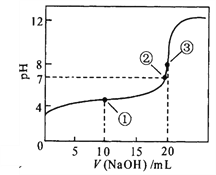
A. 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH) +c( H+)
B. 点②所示溶液中:c(Na+)=c(CH3COOH)+ c(CH3COO-)
C. 点③所示溶液中:c(Na+)>c(OH-)> c( CH3COO-) >c( H+)
D. 滴定过程中会出现:c(CH3COOH)>c( CH3COO-)>c(H+) >c( Na+)>c( OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在工农业生产中有着重要的应用,请回答下列问题: 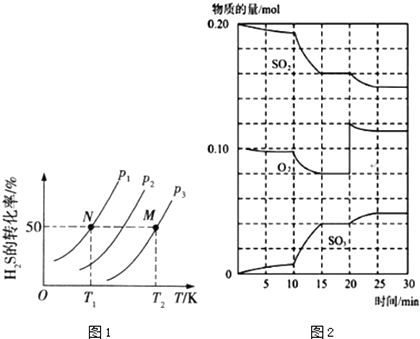
(1)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下: ①CaSO4(s)+CO(g)CaO(s)+SO2(g)+CO2(g)△=+210.5kJmol﹣1
② ![]() CaSO4(s)+CO(g)
CaSO4(s)+CO(g) ![]() CaS(s)+CO2(g)△=﹣47.3kJmol﹣1
CaS(s)+CO2(g)△=﹣47.3kJmol﹣1
反应:CaO(s)+3CO(g)+SO2(g)CaS(s)+3CO2(g)△H=kJmol﹣1
平衡常数K的表达式为 .
(2)图1为密闭容器中H2S气体分解生产H2和S2(g)的平衡转化率与温度、压强的关系. 图1中压强P1、P2、P3的大小顺序为 , 理由是 , 该反应平衡常数的大小关系为K(T1)K(T2)(“>”“=”或“<”),理由是
(3)在一定条件下,二氧化硫和氧气发生反应:2SO2(g)+O2(g)2SO3△H<0 ①600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图2,反应处于平衡状态的时间段所示
②据图2判断,反应进行至20min时,曲线发生变化的原因是(用文字表达):10min到15min的曲线变化的原因可能是(填写编号)
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加SO2的物质的量
(4)烟气中SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=(用含硫微粒浓度的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL的某稀H2S04溶液中滴入0.1mol/L氨水,溶液中水电离出氢离子浓度随滴人氨水体积变化如图.下列分析正确的是( ) 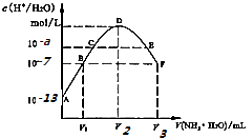
A.稀硫酸的浓度为0.1mol/L
B.C点溶液pH=14﹣a
C.E溶液中存在:c(NH4+)>c(SO42﹣)>c(H+)>c(OH﹣)
D.B到D,D到F所加氨水体积一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识填空
(1)pH=2的HCl溶液稀释1000倍,所得溶液的PH
(2)pH=2的CH3COOH溶液稀释1000倍,所得溶液的PH范围
(3)pH=11的NaOH溶液稀释100倍,所得溶液的PH
(4)pH=11的NH3H2O溶液稀释100倍,所得溶液的PH范围
(5)pH=3和pH=5的两种盐酸溶液等体积混合,所得溶液PH
(6)pH=8和pH=13的两种氢氧化钠溶液等体积混合,所得溶液PH .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是( )
A.醛基的结构简式﹣COH
B.丙烯分子的结构简式为:CH3CHCH2
C.四氯化碳分子的电子式为: ![]()
D.2﹣乙基﹣1,3﹣丁二烯的键线式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,在体积为VL的密闭容器中发生反应:mA+nBpC.t秒末,A减少了1mol,B减少了1.25mol,C增加了0.5mol.则m:n:p应为( )
A.4:5:2
B.2:5:4
C.1:3:2
D.3:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A的相对分子质量为28,可以使溴的四氯化碳溶液褪色,F高分子化合物,它有如下转化关系: 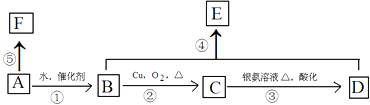
按要求填空:
(1)写出C中所含官能团的名称 , 指出④的反应类型 .
(2)若B转化为A,所需反应条件为: .
(3)写出B和F结构简式:B;F .
(4)写出反应③对应的化学方程式: .
(5)写出反应④对应的化学方程式: .
(6)E的同分异构体有多种,其中能与NaHCO3反应的同分异构体共有种.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com