
| A. | 118号是零族元素 | B. | 第七周期共有32种元素 | ||
| C. | 四种元素都有放射性 | D. | 四种元素都是金属 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:解答题
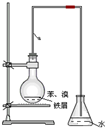 某同学设计如图装置制取少量溴苯,请回答下列问题:
某同学设计如图装置制取少量溴苯,请回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
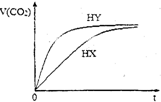 25℃时,将浓度均为0.1mol•L-1HX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )
25℃时,将浓度均为0.1mol•L-1HX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )| A. | 相同浓度的HX和HY溶液中水的电离程度:HX>HY | |
| B. | 相同体积相同浓度的HX和HY溶液中阴离子数目前者大于后者 | |
| C. | 向10mL 0.1mol•L-1的Na2CO3溶液中缓慢滴加10mL0.1mol•L-1的HY,混合后的离子浓度大小关系: c (Na+)>c (Y-)>c(HCO3-)>c (OH-)>c(H+) | |
| D. | 将等体积等浓度的HX和HY溶液分别用相同浓度的氢氧化钠溶液滴定,至中性时,消耗的氢氧化钠溶液体积前者大于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 次数 | 1 | 2 | 3 |
| 滴定体积/mL | 19.98 | 20.02 | 19.00 |
| 实验编号 | 实验操作 | 现象 |
| 1 | 向10mL 3mol/L KNO3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 无白色沉淀生成 |
| 2 | 向10mL 1mol/L AgNO3溶液中滴加2mL 0.1mol/L FeSO4溶液,振荡,再滴加酸性KMnO4溶液 | 紫红色不褪去 |
| 3 | 向10mL 1mol/L Fe(NO3)3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
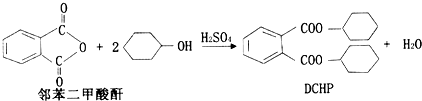
| A. | DCHP的分子式为C20H28O4 | |
| B. | 上述制备DCHP的反应属于取代反应 | |
| C. | DCHP苯环上的一氯代物有4种 | |
| D. | 1molDCHP最多可与含4molNaOH的溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
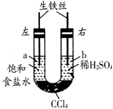 如图在盛有CCl4的U形管左右两端分别加入饱和食盐水和稀硫酸,使两边液面相平,再塞上插有铁丝的塞子,密封好,放置一段时间.下列说法错误的是( )
如图在盛有CCl4的U形管左右两端分别加入饱和食盐水和稀硫酸,使两边液面相平,再塞上插有铁丝的塞子,密封好,放置一段时间.下列说法错误的是( )| A. | 左右两边铁丝腐蚀速率一样快 | B. | 左右两边负极反应均为Fe-2e→Fe2+ | ||
| C. | 左边液面高于右边液面 | D. | 左右两边溶液的pH均升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 等浓度时,若溶液中c(X-)=c(Y-)+c(HY),则乙的pH大 | |
| B. | 等浓度时,若甲的pH大,则甲中总离子浓度大 | |
| C. | 甲浓度大时,若溶液中c(X-)=c(Y-),则甲中水的电离程度大 | |
| D. | 乙浓度大时,若酸性HX强,则乙的水解程度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10min内,Y的平均反应速率为0.03 mol•L-1•min-1 | |
| B. | 第10min时,X的反应速率为0.01 mol•L-1•min-1 | |
| C. | 10min内,消耗0.1 mol X,生成0.4 mol Z | |
| D. | 10min内,X和Y反应放出的热量为a kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
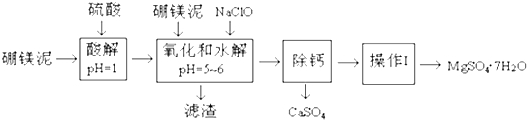
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com