
【题目】水产养殖户常用电解法净化鱼池中的水,其工作原理如下图所示。下列说法中正确的是
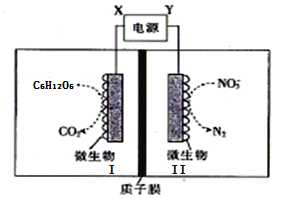
A. X极是电源的负极,发生氧化反应
B. 工作过程中阴极区溶液的pH逐渐减小
C. 当电路中转移10mole-时,Ⅱ极上产生22.4LN2
D. I极上的电极反应式:C6H12O6-24e-+6H2O==6CO2↑+24H+
【答案】D
【解析】
从装置图中可知,X端连接的I电极上,在微生物作用下,C6H12O6失电子发生氧化反应反应生成CO2,I为电解池的阳极,Y端连接的Ⅱ电极上,在微生物作用下,硝酸根离子得电子发生还原反应生成了氮气,Ⅱ为电解池的阴极,则Y为负极,X为正极。
A项、X端连接的电极上,在微生物作用下,C6H12O6失电子发生氧化反应生成CO2,为电解池的阳极,则X是电源的为正极,故A错误;
B项、Ⅱ为电解池的阴极,在微生物作用下,硝酸根离子在阴极上得电子发生还原反应生成了氮气,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,反应消耗H+,阴极区溶液的pH逐渐增大,故B错误;
C项、未明确是否为标准状况,无法计算Ⅱ极上产生N2的体积,故C错误;
D项、I为电解池的阳极,在微生物作用下,C6H12O6在阳极上失电子发生氧化反应生成CO2,电极反应式为C6H12O6-24e-+6H2O==6CO2↑+24H+,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是
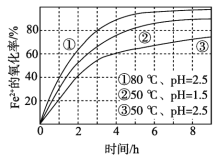
A. Fe2+的氧化率随时间延长而逐渐增大
B. 由②和③可知,pH越大,Fe2+氧化速率越快
C. 由①和③可知,温度越高,Fe2+氧化速率越快
D. 氧化过程的离子方程式为:4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 测定盐酸和NaOH溶液反应的中和热时,每次实验均应测量三个温度,即盐酸的起始温度、NaOH溶液的起始温度和反应后的终止温度
B. HCl和NaOH反应的中和热ΔH=57.3 kJ·mol1,则稀H2SO4和稀Ca(OH)2溶液反应的中和热 ΔH=2×57.3 kJ·mol1
C. 燃烧热是指在101 kPa时可燃物完全燃烧时所放出的热量
D. S(s)+ ![]() O2(g)
O2(g)![]() SO3(g) ΔH=315 kJ·mol1(燃烧热)
SO3(g) ΔH=315 kJ·mol1(燃烧热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述中,正确的是
A.不考虑空间异构,C2H6O的一氯代物有3种结构
B.分子式符合C5H11Cl的化合物有6种
C.已知二氯苯有3种同分异构体,则四氯苯的同分异构体的数目多于3种
D.菲的结构简式为![]() ,它与硝酸反应可生成6种一硝基取代物
,它与硝酸反应可生成6种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有0.1 mol·L-1 NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是

A.当pH=9时,溶液中存在下列关系:c(NH4+)>c(NH3·H2O)>c(HCO3-)>c(CO32-)
B.将0.2 mol CO2通入1 L 0.3 mol·L-1 NH3·H2O溶液中充分反应,则有:c(HCO3-)+3c(H2CO3)-c(CO32-)>0
C.向pH=6.5的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3-浓度逐渐减小
D.分析可知,常温下水解平衡常数Kh(HCO3-)的数量级为10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照绿色化学的原则,最理想的“原子经济”就是反应物的原子全部转化为所期望的最终产物,原子利用率为100%。下列制备CH3CH2OH的反应中符合“原子经济”要求的是( )
A.CH2=CH2+H2O![]() CH3CH2OH
CH3CH2OH
B.CH3COOCH2CH3+H2O![]() CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH
C.C6H12O6(葡萄糖) ![]() 2CH3CH2OH+2CO2↑
2CH3CH2OH+2CO2↑
D.CH3CH2Cl+NaOH![]() CH3CH2OH+NaCl
CH3CH2OH+NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“酒是陈的香”,就是因为酒在储存过程中生成了有香 味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题:

(1)写出制取乙酸乙酯的化学反应方程式
____________________________________________
(2)饱和碳酸钠溶液的主要作用是________、___________、___________________。
(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是__________。
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是_________。
(5)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知柠檬酸易溶于水和乙醇,有酸性和还原性。用图示裝置(夹持和加热仪器已省略)制备补血剂甘氨酸亚铁![]() (易溶于水,难溶于乙醇)。下列说法错误的是( )
(易溶于水,难溶于乙醇)。下列说法错误的是( )
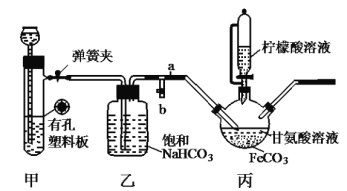
A.装置甲中所盛放的药品可以是石灰石和稀盐酸
B.加入柠檬酸溶液可调节溶液的![]() ,并防止
,并防止![]() 被氧化
被氧化
C.丙中反应方程式为![]()
D.洗涤得到的甘氨酸亚铁所用的最佳试剂是柠檬酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究原电池原理,设计如图装置。下列叙述正确的是( )

A. a和b不连接时,铁片上会有![]() 产生
产生
B. a和b用导线连接时,铁片上发生的反应为![]()
C. a和b用导线连接时,电子由a流向b
D. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com