
| 主族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | O |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
 ,故答案为:
,故答案为: ;
; ,故答案为:
,故答案为: ;
; ;钠和水反应生成NaOH,反应方程式为2Na+2H2O=2NaOH+H2↑,氯气和水反应生成HCl和HClO,反应方程式为Cl2+H2O=HCl+HClO;
;钠和水反应生成NaOH,反应方程式为2Na+2H2O=2NaOH+H2↑,氯气和水反应生成HCl和HClO,反应方程式为Cl2+H2O=HCl+HClO; ;2Na+2H2O=2NaOH+H2↑;Cl2+H2O=HCl+HClO.
;2Na+2H2O=2NaOH+H2↑;Cl2+H2O=HCl+HClO.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、用Fe除去FeCl2溶液中的少量的FeCl3杂质:Fe+Fe3+=2Fe2+ | ||
B、实验室制取NO2:Cu+4H++2NO
| ||
C、硫酸溶液与氢氧化钡溶液混合:H++SO
| ||
D、向氯化铝溶液通足量氨气:Al3++4NH3+4H2O=4NH
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、B>A>C>D |
| B、A>B>D>C |
| C、A>B>C>D |
| D、B>A>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
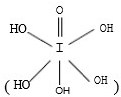 和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:I
和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:I
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com