
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
分析 (1)纯水在T℃时,pH=6,说明此时水的离子积常数为10-12,该温度下1mol•L-1的NaOH溶液中,氢离子由水电离产生,所以c(H+)=$\frac{1{0}^{-12}}{1}$mol/L,而水电离出的c(OH-)=c(H+)=10-12mol•L-1;
(2)加水稀释弱酸时,会促进弱酸的电离;依据中和反应中消耗的氢离子的物质的量等于氢氧根离子的物质的量解答;
(3)0.1mol•L-1H2A溶液,H2A=H++HA-,电离出H+为0.1mol/L,而0.1mol•L-1NaHR溶液的c(H+)=a mol•L-1,则由HA-?H++A2-可知,电离出0.1mol/LH+,对第一步电离生成的H+抑制了HA-的电离;
(4)①根据酸的电离常数进行分析判断,电离常数越大,pH越小;
②向NaCN溶液中通入少量CO2,由于酸性:H2CO3>HCN>HCO3-,故反应生成HCN和碳酸氢钠,不能生成二氧化碳,故反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3.
解答 解:(1)纯水在T℃时,pH=6,说明此时水的离子积常数为10-12,该温度下1mol•L-1的NaOH溶液中,氢离子由水电离产生,所以c(H+)=$\frac{1{0}^{-12}}{1}$mol/L,而水电离出的c(OH-)=c(H+)=10-12mol•L-1,故答案为:10-12;
(2)某一元弱酸溶液(A)与二元强酸(B)的pH相等,则弱酸有大部分为电离,加水稀释时,能够促进更多的弱酸电离,所以加水稀释后,氢离子浓度大于二元强酸中氢离子浓度,所以pHA<pHB,
上述稀释溶液中弱酸的氢离子的物质的量浓度大于强酸,所以等体积含有的氢离子的物质的量多,中和等浓度等体积的NaOH溶液,用的体积少,
故答案为:<,<;
(3)0.1mol•L-1H2A溶液,H2A=H++HA-,电离出H+为0.1mol/L,而0.1mol•L-1NaHR溶液的c(H+)=a mol•L-1,则由HA-?H++A2-可知,电离出0.1mol/LH+,对第一步电离生成的H+抑制了HA-的电离,所以0.1mol•L-1H2R溶液中c(H+)<(0.1+a) mol•L-1,故答案为:<;H2R中第一步电离出的H+对HR-的电离产生了抑制作用;
(4)①根据酸的电离常数进行分析判断,电离常数越大,pH越小,根据图表数据分析,电离常数:醋酸>HCN>碳酸氢根离子,所以三溶液的pH由大到小的顺序为H2CO3>HCN>CH3COOH,故答案为:H2CO3>HCN>CH3COOH;
②向NaCN溶液中通入少量CO2,由于酸性:H2CO3>HCN>HCO3-,故反应生成HCN和碳酸氢钠,不能生成二氧化碳,故反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3,
故答案为:NaCN+H2O+CO2=HCN+NaHCO3.
点评 本题考查盐类水解的应用,溶液中离子浓度的大小比较,综合性较强.要注意碳酸是二元弱酸分步电离,第二部电离比HCN小.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,3.2g O 2所含的原子数为0.2NA | |
| B. | 标准状况下,18g H2 O所含的氧原子数目为NA | |
| C. | 常温常压下,92g NO2和N2O 4的混合气体中含有的原子总数为6 NA | |
| D. | 标准状况下,22.4LCH4与22.4L N2所含原子数均为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.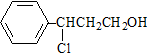 $→_{△}^{O_{2}/Cu}$$→_{Ⅱ}^{一定条件}$乙
$→_{△}^{O_{2}/Cu}$$→_{Ⅱ}^{一定条件}$乙 ,设计步骤Ⅰ的目的是保护碳碳双键,防止被氧化.
,设计步骤Ⅰ的目的是保护碳碳双键,防止被氧化.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度可以增大活化分子百分数,从而使反应速率增大 | |
| B. | 汽车尾气的催化转化装置可将尾气中的NO和CO等有害气体快速地转化为N2和CO2,其原因是催化剂可增大NO和CO反应的活化能 | |
| C. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| D. | 在“中和热的测量实验”中测定反应后温度的操作方法:将量筒中的NaOH溶液经玻璃棒引流缓缓倒入盛有盐酸的简易量热计中,立即盖上盖板,并用环形玻璃搅拌棒不断搅拌,准确读出并记录反应体系的最高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| C-H | C-O | C=O | H-H | H-O |
| 413.4 | 351 | 745 | 436 | 462.8 |
| 实验 | 温度/℃ | 起始量] | 达到平衡 | |||
| CO/mol | H2O/mol | H2/mol | CO转化率 | 所需时间/min | ||
| 1 | 650 | 4 | 2 | 1.6 | 6 | |
| 2 | 900 | 2 | 1 | 25% | 3 | |
| 3 | 900 | a | b | c | t | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为纪念化学学科所取得的成就以及对人类文明的贡献,联合国将2011年定为“国际化学年”,其主题为“化学──我们的生活,我们的未来”.化学关注食品安全、人类健康和社会的可持续发展,为改善人类生活质量、提高人类生活水平发挥了重要作用.请回答下列问题:
为纪念化学学科所取得的成就以及对人类文明的贡献,联合国将2011年定为“国际化学年”,其主题为“化学──我们的生活,我们的未来”.化学关注食品安全、人类健康和社会的可持续发展,为改善人类生活质量、提高人类生活水平发挥了重要作用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 陈述Ⅰ | 陈述Ⅱ | |
| A | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| B | 非金属性:Cl>S | 酸性:HClO3>H2SO4 |
| C | 常温下,NaHCO3的溶解度比Na2CO3小 | 向饱和Na2CO3溶液中通入CO2产生沉淀 |
| D | 常温下,SO2与氢硫酸和NaOH溶液均可反应 | SO2是两性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Na+、Cl-、OH- | B. | Fe3+、Cl-、K+、Ca2+ | ||
| C. | Cl-、Ca2+、Mg2+、CO32- | D. | Ba2+、K+、CO32-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com