
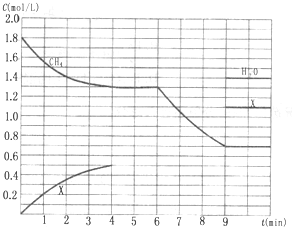
 向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:| 2mol/L |
| 4min |
| 0.5×24 |
| 1.3×2.62 |


科目:高中化学 来源: 题型:阅读理解
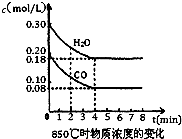 已知反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,生成的CO2与H2以不同的体积比混合时在合适条件下的反应可制得CH4.
已知反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,生成的CO2与H2以不同的体积比混合时在合适条件下的反应可制得CH4.| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
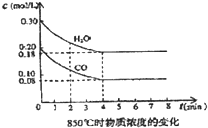 在一体积为10L的容器中,通入一定量的CO和H2O,在85℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-Q kJ/mol CO和H2O浓度变化如图,则
在一体积为10L的容器中,通入一定量的CO和H2O,在85℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-Q kJ/mol CO和H2O浓度变化如图,则| 时间 | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:
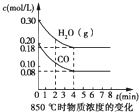 某研究小组利用反应CO(g)+H2O(g)?CO2(g)+2H2(g)△H=-41.2kJ/mol,制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积之比混合时在合适条件下的反应情况.请回答下列问题:
某研究小组利用反应CO(g)+H2O(g)?CO2(g)+2H2(g)△H=-41.2kJ/mol,制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积之比混合时在合适条件下的反应情况.请回答下列问题:查看答案和解析>>
科目:高中化学 来源:2013年山东省高考化学模拟试卷(三)(解析版) 题型:解答题
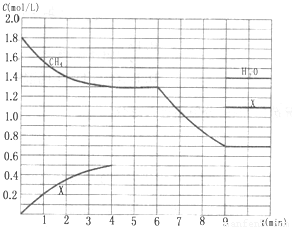
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com