
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。
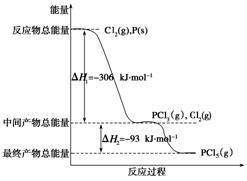
根据上图回答下列问题:
(1) P和Cl2反应生成PCl3的热化学方程式是________________________________
________________________________________________________________________。
(2) PCl5分解成PCl3和Cl2的热化学方程式是_________________________________
________________________________________________________________________。
(3)P和Cl2分两步反应生成1 mol PCl5的ΔH3=__________________,P和Cl2一步反应生成1 mol PCl5的ΔH4____ΔH3(填“大于”、“小于”或“等于”)。
答案 (1)P(s)+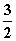 Cl2(g)===PCl3(g) ΔH=-306 kJ·mol-1
Cl2(g)===PCl3(g) ΔH=-306 kJ·mol-1
(2)PCl5(g)===PCl3(g)+Cl2(g) ΔH=93 kJ·mol-1
(3)-399 kJ·mol-1 等于
解析 (1)产物的总能量减去反应物的总能量就等于反应热,结合图象可知,PCl3和反应物P和Cl2的能量差值为306 kJ,因此该热化学反应方程式为:
P(s)+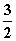 Cl2(g)===PCl3(g) ΔH=-306 kJ·mol-1。
Cl2(g)===PCl3(g) ΔH=-306 kJ·mol-1。
(2)根据图象可知PCl5和PCl3、Cl2之间的能量差值为93 kJ,因此PCl5分解成PCl3和Cl2的热化学方程式为:
PCl5(g)===PCl3(g)+Cl2(g) ΔH=93 kJ·mol-1。
(3)根据盖斯定律求得:ΔH3=-399 kJ·mol-1,且ΔH3=ΔH4,与反应的途径无关,只与起始物质、终了物质有关。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:
煤是一种常用的燃料。由于煤燃烧产生的废气中含有SO2、NO2和NO等多种有害气体和烟尘,会对环境造成污染,因此需要对煤进行加工后再燃烧,或将废气净化后再排放。
(1)将煤直接进行燃烧,造成环境污染的主要原因之一是形成硝酸型酸雨。
①写出有关物质转化为硝酸的化学方程式 。
②以下是对硝酸型酸雨的评价,其中正确的是 (用序号填空)。
a.杀死水中的浮游生物,减少鱼类食物来源,破坏水生生态系统
b.对电线、铁轨、桥梁、房屋等均会造成严重损害
c.破坏臭氧层
d.硝酸与土壤中的矿物质发生作用转化为硝酸盐,向植物提供氮肥
(2)如图是对煤燃烧产生的废气进行常温脱硫处理的基本流程示意图,试写出在废气脱硫并形成副产物的过程中所发生的主要化学反应的化学方程式________
___________________________________________________________________。
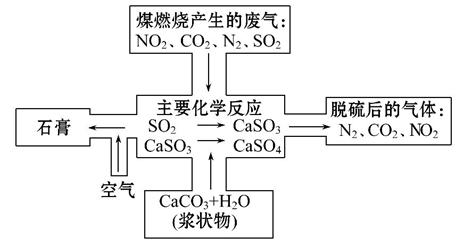
(3)脱硫以后,在废气中含量明显增加的不良气体是(写物质名称) ,它对环境的负面影响是 。
(4)检验脱硫后废气中是否含有SO2的简单方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
A.【物质结构与性质】
可以由下列反应合成三聚氰胺:CaO+3C CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2  CN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
CN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式: 。 CaCN2中阴离子为CN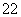 ,根据等电子原理可以推知CN
,根据等电子原理可以推知CN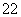 的空间构型为 。
的空间构型为 。
 (2)尿素分子中C原子采取 杂化。尿素分子的结构简式是 。
(2)尿素分子中C原子采取 杂化。尿素分子的结构简式是 。
(3)三聚氰胺( )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸( )
后,三聚氰酸与三聚氰胺分子相互之间通过 结合,在肾脏内易形成结石。
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为 。
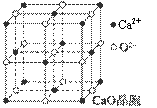

(5)CaO晶体和NaCl晶体的晶格能分别为:CaO 3401 kJ·mol-1、NaCl 786 kJ·mol-1。导致CaO比NaCl晶格能大的主要原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
燃烧热是指1 mol可燃物充分燃烧生成稳定氧化物时放出的热量。已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8 kJ·mol-1、-1 411.0 kJ·mol-1和-1 366.8 kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为( )
A.-44.2 kJ·mol-1 B.44.2 kJ·mol-1
C.-330 kJ·mol-1 D.330 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
今有如下三个热化学方程式:
H2(g)+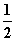 O2(g)===H2O(g) ΔH=a kJ·mol-1
O2(g)===H2O(g) ΔH=a kJ·mol-1
H2(g)+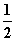 O2(g)===H2O(l) ΔH=b kJ·mol-1
O2(g)===H2O(l) ΔH=b kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH=c kJ·mol-1
下列关于它们的表述正确的是( )
A.它们都是吸热反应 B.a、b和c均为正值
C.a=b D.2b=c
查看答案和解析>>
科目:高中化学 来源: 题型:
在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( )
A.正极附近的SO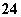 离子浓度逐渐增大
离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中正确的是( )
A.澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+====Ca2++2H2O
B.钠与水的反应:Na+2H2O====Na++2OH-+H2↑
C.铜片插入硝酸银溶液中:Cu+Ag+====Cu2++Ag
D.大理石溶于醋酸的反应:CaCO3+2CH3COOH====Ca2++2CH3COO-+CO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com