
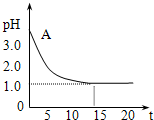
 电解氯化铜溶液时,实验测得其溶液的pH变化如图所示.下列有关说法中不正确的是( )
电解氯化铜溶液时,实验测得其溶液的pH变化如图所示.下列有关说法中不正确的是( )
| ||


科目:高中化学 来源: 题型:
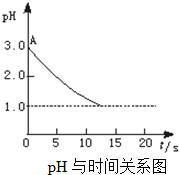 关于“电解氯化铜溶液时的pH变化”问题,化学界有以下两种不同的观点:观点一是:“理论派”认为电解氯化铜溶液后溶液的pH升高.观点二是:“实验派”经过反复、多次、精确的实验测定,证明电解氯化铜溶液时pH的变化如图曲线的关系.?请回答下列问题:
关于“电解氯化铜溶液时的pH变化”问题,化学界有以下两种不同的观点:观点一是:“理论派”认为电解氯化铜溶液后溶液的pH升高.观点二是:“实验派”经过反复、多次、精确的实验测定,证明电解氯化铜溶液时pH的变化如图曲线的关系.?请回答下列问题:| 水解 |
| 水解 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 颜色、性质 | 物质 | 颜色、性质 |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 |
| 氧化亚铜(CuO) | 红色固体不溶于水 | 氯化铜(CuCl2) | 溶液呈绿色,稀溶液呈蓝色 |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
电解氯化铜溶液时,实验测得其溶液的pH变化如图所示。下列有关说法中不正确的是
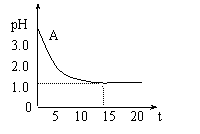 A.电解氯化铜溶液的方程式为:
A.电解氯化铜溶液的方程式为:![]()
B.在电解过程中,溶液中H+ 浓度逐渐减小
C.随着电解的进行,溶液中Cu2+ 浓度逐渐减小,由Cu2+水解产生的H+越来越少
D.电解时阳极上产生的氯气溶于水,生成HClO和HCl,使氢离子浓度增大,pH变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com