
(本题共13分)
氨气是重要的化工原料,工业上利用N2和H2合成NH3,方程式如下:N2 +3H2 2NH3
2NH3
29.已知NH3难溶于CCl4,则下列装置中,不能用于吸收氨气的是

30.某温度下,在一体积恒定为10L的密闭容器内模拟合成氨反应。若开始时充入:0.1mol N2、0.1mol H2和0.2mol NH3,则此时
 (填“>”或“<”或“=”,已知该温度下,平衡常数K值为
(填“>”或“<”或“=”,已知该温度下,平衡常数K值为 )。
)。
若要增大反应速率,且平衡向正反应方向移动,下列措施中可行的是 (填字母代号)。
A.压缩容器体积 B.适当升高温度
C.通入适量氮气 D.加适量催化剂
31.能说明上述反应达到平衡状态的是
A.2υ (H2) 3υ(NH3)
3υ(NH3)
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.单位时间内生成n mol N2的同时生成2n mol NH3
32.氨气溶于水所得溶液在加水稀释的过程中(本小题填“增大”或“减小”或“不变”),NH3·H2O的电离程度 ,电离平衡常数 ,溶液的pH值 。
33.氨气与酸反应得到铵盐,某(NH4)2SO4水溶液的pH=5,原因是溶液中存在平衡 (用离子方程式表示),该稀溶液中水的电离度约为 。
(共13分)29.B(1分) ;30.< (2分) A、C (2分) ;31.C、D (2分)
32.增大、不变、减小 (各1分)
33.NH4++H2O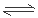 NH3·H2O + H+ (1分) 1.8×10-5% 或1.8×10-7 (2分)
NH3·H2O + H+ (1分) 1.8×10-5% 或1.8×10-7 (2分)
【解析】
试题分析:29.氨气极容易溶于水,为了使氨气被充分吸收,同时又防止倒吸现象的发生,通常在导气管的末端安装一个倒扣的漏斗或一个干燥管,当氨气溶解是导气管内气体的压强减小时,水进入漏斗或干燥管,因为它们的容积较大,当较大量的水进入该装置时,烧杯内的水面下降,漏斗过干燥管内的水又流回到烧杯内,从而防止了倒吸的发生;也可以将导气管伸入到氨气不能溶解、密度比水大的有机物若CCl4中,气体从导气管内逸出,在上升的过程中遇水,发生反应、溶解,同时也防止了倒吸的发生,而B中导气管直接伸入水中会引起倒吸现象的发生,故选项是B。
30.在反应开始时,c(N2)=0.01mol/L,c(H2)=0.01mol/L,c(NH3)=0.02mol/L,Qc=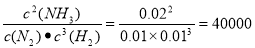 >K=
>K= 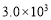 ,说明平衡逆向移动,
,说明平衡逆向移动,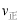 <
<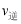 ; A.压缩容器体积物质的浓度增大,体系的压强增大,正反应速率加快,由于正反应是气体体积减小的反应,所以增大压强,平衡正向移动,正确;B.适当升高温度单位体积内活化分子数增加,化学反应速率加快,由于该反应的正反应是放热反应,升高温度,平衡向吸热的逆反应方向移动,错误;C.通入适量氮气,即增大了反应物的浓度正反应速率加快,增大反应物浓度,平衡向正反应方向移动,正确;D.加适量催化剂,正反应和逆反应的速率都加快,由于催化剂对正反应和逆反应速率影响相同,所以加入催化剂,平衡不发生移动,错误;选项A、C。
; A.压缩容器体积物质的浓度增大,体系的压强增大,正反应速率加快,由于正反应是气体体积减小的反应,所以增大压强,平衡正向移动,正确;B.适当升高温度单位体积内活化分子数增加,化学反应速率加快,由于该反应的正反应是放热反应,升高温度,平衡向吸热的逆反应方向移动,错误;C.通入适量氮气,即增大了反应物的浓度正反应速率加快,增大反应物浓度,平衡向正反应方向移动,正确;D.加适量催化剂,正反应和逆反应的速率都加快,由于催化剂对正反应和逆反应速率影响相同,所以加入催化剂,平衡不发生移动,错误;选项A、C。
31. A.根据方程式中氢气与氨气的系数关系可知,在任何时刻都存在2υ (H2) 3υ(NH3),因此不能作为判断平衡的标志,错误;B.由于反应是在体积恒定不变的容器内进行的反应,反应前后气体物质的质量不变,所以在任何时刻都存在混合气体的密度不变,故不能作为判断平衡的标志,错误;C.该反应的正反应是气体体积减小的反应,若反应为达到平衡状态,则气体的物质的量就会发生变化,而气体的质量也不变,则混合气体的平均相对分子质量就必然发生改变,现在气体的相对分子质量不变,说明气体的物质的量不变,反应处于平衡状态,正确;D.单位时间内生成n mol N2,就会同时消耗2nmol的NH3,此时还同时生成2n mol NH3,则氨气的物质的量不变,反应处于平衡状态,正确。
3υ(NH3),因此不能作为判断平衡的标志,错误;B.由于反应是在体积恒定不变的容器内进行的反应,反应前后气体物质的质量不变,所以在任何时刻都存在混合气体的密度不变,故不能作为判断平衡的标志,错误;C.该反应的正反应是气体体积减小的反应,若反应为达到平衡状态,则气体的物质的量就会发生变化,而气体的质量也不变,则混合气体的平均相对分子质量就必然发生改变,现在气体的相对分子质量不变,说明气体的物质的量不变,反应处于平衡状态,正确;D.单位时间内生成n mol N2,就会同时消耗2nmol的NH3,此时还同时生成2n mol NH3,则氨气的物质的量不变,反应处于平衡状态,正确。
32.氨气溶于水得到氨水,在氨水中存在电离平衡:NH3 · H2O NH4++OH-,在所得溶液在加水稀释的过程中,由于离子浓度减小的倍数大于电解质分子极性的倍数,所以电离平衡正向移动,即NH3 · H2O的电离程度增大,而电离平衡常数至于温度有关,温度不变,则电离平衡常数就不变,加水对溶液中的离子起稀释作用,是离子浓度减小,平衡正向移动是离子浓度又增大,但是平衡移动的趋势是微弱的,所以总的来说,溶液中c(OH-)浓度减小,所以溶液的pH值减小;
NH4++OH-,在所得溶液在加水稀释的过程中,由于离子浓度减小的倍数大于电解质分子极性的倍数,所以电离平衡正向移动,即NH3 · H2O的电离程度增大,而电离平衡常数至于温度有关,温度不变,则电离平衡常数就不变,加水对溶液中的离子起稀释作用,是离子浓度减小,平衡正向移动是离子浓度又增大,但是平衡移动的趋势是微弱的,所以总的来说,溶液中c(OH-)浓度减小,所以溶液的pH值减小;
33.某(NH4)2SO4水溶液的pH=5,是因为在NH4+在溶液发生水解反应NH4++ H2O  NH3 · H2O +H+,消耗了水电离产生的OH-,破坏了水的电离平衡,当最终达到平衡时溶液中c(H+)>c(OH-),所以溶液显酸性。溶液的pH=5, c(H+)=10-5mol/L,由于水的浓度是c(H2O)=(1000g÷18g/mol) ÷1L=(1000/18)mol/L,则该稀溶液中水的电离度约为(10-5mol/L÷(18/1000)mol/L)×100%=1.8×10-5% 。
NH3 · H2O +H+,消耗了水电离产生的OH-,破坏了水的电离平衡,当最终达到平衡时溶液中c(H+)>c(OH-),所以溶液显酸性。溶液的pH=5, c(H+)=10-5mol/L,由于水的浓度是c(H2O)=(1000g÷18g/mol) ÷1L=(1000/18)mol/L,则该稀溶液中水的电离度约为(10-5mol/L÷(18/1000)mol/L)×100%=1.8×10-5% 。
考点:考查防止倒吸的装置、化学平衡常数的计算与反应进行的方向的判断、影响化学反应速率和平衡移动的因素、平衡状态的判断、溶液稀释对弱电解质电离平衡的影响、盐的水解及水电离度的计算。


科目:高中化学 来源:2014-2015学年北京市海淀区高三上学期期末化学试卷(解析版) 题型:选择题
下述实验方案能达到实验目的的是
编号 | A | B | C | D |
实验 方案 | |
|
|
|
实验 目的 | 实验室制备乙酸乙酯 | 分离乙酸和水 | 验证溴乙烷在氢氧化钠乙醇溶液中发生消去反应产生的乙烯 | 收集乙烯并验证它与溴水发生加成反应 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省红河州高三统一检测理综化学试卷(解析版) 题型:填空题
【化学-选修2:化学与技术】(15分)
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成的。由蛇纹石制取碱式碳酸镁的实验步骤如下:

(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是_ 。
(2)进行Ⅰ操作时,控制溶液的pH=7~8(有关氢氧化物沉淀的pH见下表),则沉淀物A的主要成份为 ,沉淀物B的主要成份为 。
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀的PH值 | 1.5 | 3.3 | 9.4 |
(3)若要从沉淀物A中提取出某种可用于工业冶炼铝的原料,应先向A中加入 溶液(填物质化学式)再过滤,然后向滤液中通入过量CO2,过滤、灼烧。请写出通入CO2时发生反应的离子方程式 。
(4)为确定产品aMgCO3?bMg(OH)2?cH2O中a、b、c的值,称取18.2g样品完全分解后,测得产生6.6gCO2和8.0g MgO,由此可知,产品的化学式中a=______、b=_______、c=______。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省部分高三1月份统一考试理综化学试卷(解析版) 题型:选择题
下列离子方程式的书写及评价均合理的是
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入到含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确; Cl2过量,Fe2+、I-均被氧化 |
B | 用Cu电极电解NaCl溶液阳极的电极反应式: 2Cl--2e-===Cl2↑ | 正确; Cl-优先于OH-放电 |
C | 过量SO2通入到NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确; H2SO3的酸性强于HClO |
D | Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2++2HCO3-+4OH-=== Mg(OH)2 ↓ +2 CO32-+2 H2O | 正确; Mg(OH)2比MgCO3更难溶 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市崇明县高三上学期期末考试化学试卷(解析版) 题型:计算题
(本题共14分)合金的性能往往优于组成金属,因而用途非常广泛。钠钾合金可在核反应堆中用作导热剂。5.05g钠钾合金溶于200mL水生成0.075mol氢气。
54.计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)。
55.计算并确定该钠-钾合金的化学式。
镁铝合金广泛用于火箭、导弹和飞机制造业等。取不同质量的镁铝合金样品分别和30ml相同浓度的盐酸反应,所取合金质量与产生气体体积(标况下)如下表所示:
实验序号 | A | B | C |
合金质量/mg | 510 | 765 | 918 |
气体体积/mL | 560 | 672 | 672 |
56.计算镁铝合金中镁铝的质量之比。
铜锡合金,又称青铜,是人类使用最早的合金。不同的铜锡比例可以产生不同的效用,若含锡量为1/4—1/7(质量比)的青铜被称作重青铜,受敲击时能发出洪亮的声音。
57.现有一铜锡合金样品,可通过至少增加ag铜或至少减少bg锡恰好使其成为钟青铜,且最终得到的钟青铜质量正好相差一半。求原铜锡合金样品中铜锡的物质的量之比。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市崇明县高三上学期期末考试化学试卷(解析版) 题型:选择题
如下图所示,在毛玻璃片上放有一张浸有含酚酞的饱和氯化钠溶液的滤纸,滤纸上点有A、B、C、D四个点(指靠近电极的溶液)。有关说法正确的是
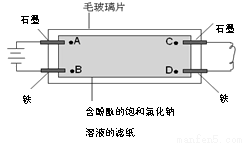
A.A点比B点先出现红色 B.B点比A点先出现红色
C.A点比C点先出现红色 D.D点比C点先出现红色
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市崇明县高三上学期期末考试化学试卷(解析版) 题型:选择题
pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是
A.加入适量的氯化铵晶体后,两溶液的pH均碱小
B.温度下降10°C,两溶液的pH均不变
C.分别加水稀释10倍,两溶液的pH仍相等
D.用同浓度的盐酸中和,消耗盐酸的体积相同
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三元月模拟测试化学试卷(解析版) 题型:选择题
复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断不正确的是
A.在含等物质的量的Ba(OH)2、KOH的混合溶液中缓慢通入CO2:KOH、 Ba(OH)2、K2CO3、BaCO3
B.在含等物质的量的FeBr2、FeI2的溶液中缓慢通入氯气:I-、Fe2+、Br-
C.在含等物质的量的[Al(OH)4]—、OH-、CO32-的溶液中逐滴加入盐酸:[Al(OH)4]-、Al(OH)3、OH -、CO32-
D.在含等物质的量的Fe2+、Ag+、Cu2+、H+的溶液中加入锌粉:Ag+、Cu2+、H+、Fe2+
查看答案和解析>>
科目:高中化学 来源:2014--2015吉林省高一上学期期末化学试卷(解析版) 题型:选择题
硅及其化合物在材料领域中应用广泛。下列说法正确的是
A.水晶项链是硅酸盐制品 B.硅单质广泛用于光纤通讯
C.利用盐酸刻蚀石英制作艺术品 D.硅酸钠可用于制备木材防火剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com