
·ÖĪö £Ø1£©»ÆŃ§Ę½ŗā³£Źż=$\frac{Éś³ÉĪļÅضČĻµŹżĆŻ“Ī·½}{·“Ó¦ĪļÅضČĻµŹżĆŻ“Ī·½}$£¬¾Ż“Ė½ųŠŠ½ā“š£»
£Ø2£©¾Ż»Æѧ·½³ĢŹ½æÉÖŖ£¬Éś³É0.5molµāµ„ÖŹ·Ö½āĮĖ1molHI£¬·“Ó¦æŖŹ¼Ē°HIÅضČĪŖ5mol/L£¬·Ö½āĀŹ=$\frac{·“Ó¦Īļ·Ö½āÅضČ}{·“Ó¦ĪļĘšŹ¼ÅضČ}$”Į100%£»
£Ø3£©·“Ó¦“ļµ½Ę½ŗāדĢ¬Ź±£¬ÕżÄę·“Ó¦ĖŁĀŹĻąµČ£¬ø÷×é·ÖÅØ¶Č²»±ä£¬¾Ż“Ė½ųŠŠÅŠ¶Ļ£»
£Ø4£©¾ŻQcÓėK“óŠ”ÅŠ¶Ļ·“Ó¦·½Ļņ£»øĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬øł¾ŻĘ½ŗāĻņÓŅµÄŌĄķÅŠ¶Ļ£®
½ā“š ½ā£ŗ£Ø1£©·“Ó¦2HI£Øg£©?H2£Øg£©+I2£Øg£©µÄĘ½ŗā³£Źż±ķ“ļŹ½ĪŖ£ŗK=$\frac{c£Ø{H}_{2}£©•c£Ø{I}_{2}£©}{{c}^{2}£ØHI£©}$£¬H2£Øg£©+I2£Øg£©?2HI£Øg£©Ę½ŗā³£ŹżµÄ±ķ“ļŹ½ĪŖK1=$\frac{{c}^{2}£ØHI£©}{c£Ø{H}_{2}£©•c£Ø{I}_{2}£©}$=$\frac{1}{K}$£¬
¹Ź“š°øĪŖ£ŗ$\frac{c£Ø{H}_{2}£©•c£Ø{I}_{2}£©}{{c}^{2}£ØHI£©}$£»$\frac{1}{K}$£»
£Ø2£©µ±·“Ó¦“ļµ½Ę½ŗāŹ±c£ØI2£©=0.5mol/L£¬c£ØHI£©=4mol/L£¬øł¾Ż·“Ó¦2HI£Øg£©?H2£Øg£©+I2£Øg£©æÉÖŖ£¬Ę½ŗāŹ±c£ØH2£©=c£ØI2£©=0.5mol/L£¬·“Ó¦ĻūŗÄHIµÄÅضČĪŖ£ŗc£ØHI£©ĻūŗÄ=2c£ØH2£©ØT1mol/L£¬Ōņ·“Ó¦Ē°HIµÄ×ÜÅضČĪŖ£ŗ4mol/L+1mol/L=5mol/L£¬ĖłŅŌHIµÄ·Ö½āĀŹĪŖ£ŗ$\frac{1mol/L}{5mol/L}$”Į100%=20%£¬
¹Ź“š°øĪŖ£ŗ0.5mol/L£»20%£»
£Ø3£©A£®øĆ·“Ó¦ĪŖĘųĢåĢå»ż²»±äµÄ·“Ó¦£¬Ōņ·“Ó¦¹ż³ĢÖŠŃ¹ĒæŹ¼ÖÕ²»±ä£¬Ōņ²»ÄÜøł¾ŻČŻĘ÷ÖŠŃ¹ĒæÅŠ¶ĻĘ½ŗāדĢ¬£¬¹ŹA“ķĪó£»
B£®»ģŗĻĘųĢåÖŠc£ØHI£©²»±ä£¬±ķĆ÷ÕżÄę·“Ó¦ĖŁĀŹĻąµČ£¬øĆ·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬¹ŹBÕżČ·£»
C£®c£ØI2£©=c£ØH2£©£¬Ć»ÓŠÖø³öÕżÄę·“Ó¦ĖŁĀŹ£¬ĪŽ·ØÅŠ¶ĻĘ½ŗāדĢ¬£¬¹ŹC“ķĪó£»
D£®v£ØHI£©Õż=v£ØH2£©Äę£¬±ķŹ¾µÄŹĒÕżÄę·“Ó¦ĖŁĀŹ£¬µ«ŹĒ²»Āś×ć¼ĘĮæŹż¹ŲĻµ£¬ĖµĆ÷ƻӊ“ļµ½Ę½ŗāדĢ¬£¬¹ŹD“ķĪó£»
¹Ź“š°øĪŖ£ŗB£»
£Ø4£©ČŻĘ÷ÄŚø÷ĪļÖŹµÄČܶȷֱšĪŖc£ØHI£©=2.0mol/L£¬c£ØI2£©=1.0mol/L£¬c£ØH2£©=1.0mol/L£¬Ōņ“ĖŹ±ÅضČÉĢQc=$\frac{1.0”Į1.0}{{2.0}^{2}}$=0.25£¼K=1£¬±ķĆ÷·“Ó¦ĪļÅØ¶Č½Ļ“ó£¬Ę½ŗāÕżĻņ×ÅÕżĻņŅĘ¶Æ£»øĆ·“Ó¦µÄ”÷H£¼0£¬ĪŖ·ÅČČ·“Ó¦£¬ŌņÉżøßĪĀ¶ČŗóĘ½ŗāĻņ×ÅĪüČȵÄÄęĻņŅĘ¶Æ£¬
¹Ź“š°øĪŖ£ŗÕżĻņ£»ÄęĻņ£®
µćĘĄ ±¾Ģāæ¼²éĮĖ»ÆŃ§Ę½ŗāµÄ¼ĘĖć£¬ĢāÄæÄѶČÖŠµČ£¬Éę¼°»ÆŃ§Ę½ŗā³£Źż”¢×Ŗ»ÆĀŹ”¢Ę½ŗā»ÆŃ§Ę½ŗāדĢ¬µÄÅŠ¶Ļ”¢»ÆŃ§Ę½ŗāµÄÓ°ĻģŅņĖŲµČÖŖŹ¶£¬Ć÷Č·»ÆŃ§Ę½ŗā¼°ĘäÓ°ĻģĪŖ½ā“š¹Ų¼ü£¬ŹŌĢāÅąŃųĮĖѧɜµÄ·ÖĪö”¢Ąķ½āÄÜĮ¦¼°»Æѧ¼ĘĖćÄÜĮ¦£®


 ĆūŠ£æĪĢĆĻµĮŠ“š°ø
ĆūŠ£æĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Na2O”śNaOH | B£® | Fe”śFeCl2 | C£® | CuO”śCu | D£® | H2O2”śH2O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | CuSO4 | B£® | NaOH | C£® | AgNO3 | D£® | NaCl |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
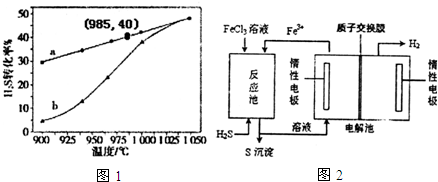
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ×é³ÉĪŖC4H8µÄ»ÆŗĻĪļŠŌÖŹ¶¼ĻąĶ¬ | |
| B£® | ĒāµÆŌĮĻD”¢T£¬æÉÓÉ${\;}_1^1$HŌŚ»Æѧ·“Ó¦ÖŠÖĘČ” | |
| C£® | “ÖĶµē½ā¾«Į¶Ź±£¬Ńō¼«¼õÉŁµÄÖŹĮæŅ»¶ØµČÓŚŅõ¼«Ōö¼ÓµÄÖŹĮæ | |
| D£® | Ķ¼ÖŠĪļÖŹA¾²»Ķ¬Ķ¾¾¶Éś³ÉBŹ±£¬ģŹ±äĀś×ć£ŗ”÷H1=”÷H2+”÷H3=”÷H4+”÷H5+”÷H6 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
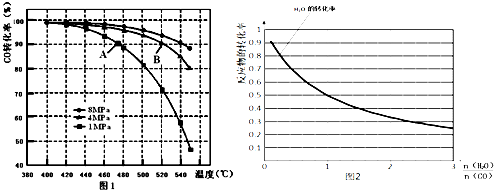
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ĪĀ¶Č/”ę | 15 | 20 | 25 | 30 | 35 |
| Ę½ŗā×ÜŃ¹Ēæ/kPa | 5.7 | 8.3 | 12 | 17.1 | 24 |
| Ę½ŗāĘųĢå×ÜÅضČ/mol•L-1 | 2.4”Į10-3 | 3.4”Į10-3 | 4.8”Į10-3 | 6.8”Į10-3 | 9.4”Į10-3 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com