
【题目】短周期元素A、B、C、D,原子序数依次增大,A的基态原子的L层电子是K层电子的两倍;B的价电子层中的未成对电子有3个;C与B同族;D的最高价含氧酸为酸性最强的无机含氧酸。请回答下列问题:
(1)C的基态原子的电子排布式为___________;D的最高价含氧酸酸性比其低两价的含氧酸酸性强的原因是_____________________________________________。
(2)杂化轨道分为等性和不等性杂化,不等性杂化时在杂化轨道中有不参加成键的孤电子对的存在。A、B、C都分别能与D形成中心原子杂化方式均为___________的共价化合物X、Y、Z。其中,属于不等性杂化的是___________ (写化学式)。
(3)比较Y、Z的熔沸点Y______Z(填“>”、“<”或“=”),并解释理由_____________________。
(4)D元素能与Cu形成棕黄色固体,加水溶解并稀释过程中,溶液颜色由绿色逐渐转化为蓝色,显绿色离子是_________________,显蓝色离子中的配位原子________________。
(5)A和B能形成多种结构的晶体。其中一种类似石墨的结构,其结构如下图所示(图1为晶体结构,图2为切片层状结构),其化学式为__________。实验测得此晶体结构属于六方晶系,晶胞结构见图3。已知图示原子都包含在晶胞内,晶胞参数a=0.64nm,c=0.24nm。其晶体密度为__________g/cm3(已知:2=1.414,后=1.732,结果精确到小数点后第2位。)

【答案】 1s22s22p63s23p3 高氯酸中非羟基氧原子为3个,氯酸中为2个或高氯酸中Cl元素为+7价,吸引羟基氧原子的能力很强,而氯酸Cl元素为+5价对羟基氧原子吸引能力较弱 sp3杂化 NCl3、PCl3 < NCl3、PCl3均为分子晶体,均无氢键,对分子质量PCl3大,熔沸点高 [CuCl4]2- O C3N4 3.59
【解析】A的基态原子的L层电子是K层电子的两倍,A为C,B的价电子层中的未成对电子有3个,则B处于ⅤA族,C与B同族,B为N,C为P,D的最高价含氧酸为酸性最强的无机含氧酸,则D为Cl。综上所述,A为C,B为N,C为P,D为Cl。
(1)C为P,其基态原子的电子排布式为![]() ;D为Cl,含氧酸中非羟基氧数目越多,中心元素化合价越高,酸性越强,高氯酸中非羟基氧原子为3个,氯酸中为2个或高氯酸中Cl元素为+7价,吸引羟基氧原子的能力很强,而氯酸中Cl元素为+5价,对羟基氧原子吸引能力较弱;正确答案:1s22s22p63s23p3 ;高氯酸中非羟基氧原子为3个,氯酸中为2个或高氯酸中Cl元素为+7价,吸引羟基氧原子的能力很强,而氯酸Cl元素为+5价对羟基氧原子吸引能力较弱。
;D为Cl,含氧酸中非羟基氧数目越多,中心元素化合价越高,酸性越强,高氯酸中非羟基氧原子为3个,氯酸中为2个或高氯酸中Cl元素为+7价,吸引羟基氧原子的能力很强,而氯酸中Cl元素为+5价,对羟基氧原子吸引能力较弱;正确答案:1s22s22p63s23p3 ;高氯酸中非羟基氧原子为3个,氯酸中为2个或高氯酸中Cl元素为+7价,吸引羟基氧原子的能力很强,而氯酸Cl元素为+5价对羟基氧原子吸引能力较弱。
(2)杂化轨道分为等性和不等性杂化,不等性杂化时在杂化轨道中有不参加成键的孤电子对的存在。C、N、P均可与Cl形成CCl4、NCl3 、PCl3,中心原子轨道杂化方式均为![]() 杂化,其中NCl3、PCl3均含有孤电子对,属于不等性杂化;正确答案:sp3杂化;NCl3、PCl3。
杂化,其中NCl3、PCl3均含有孤电子对,属于不等性杂化;正确答案:sp3杂化;NCl3、PCl3。
(3)NCl3、PCl3均为分子晶体,均无氢键;结构相似的分子晶体,相对分子质量越大,熔沸点越高,因此NCl3晶体的沸点小于PCl3晶体的沸点;正确答案:< ;NCl3、PCl3均为分子晶体,均无氢键,对分子质量PCl3大,熔沸点高。
4)氯元素能与Cu形成棕黄色固体氯化铜,当加水稀释时,水分子少,氯离子多,因此铜离子主要以[CuCl4]2- 存在,溶液显绿色;当水分子多,氯离子少时,铜离子主要以水合铜离子([Cu(H2O)4]2+)的形式存在,溶液显蓝色,显蓝色离子中的配位原子为O;正确答案:[CuCl4]2- ;O。
(5)C和N能形成多种结构的晶体,其中一种类似于金刚石的结构,硬度比金刚石大,属于原子晶体,图2切片层状结构中菱形内为层内重复结构单元,含有6个C原子,8个N原子,C、N数目比为3:4,故化学式为C3N4 ;实验测得此晶体结构属于六方晶系,晶胞结构所示原子都包含在晶胞内,晶胞质量为![]() ,晶胞体积为
,晶胞体积为![]() ,晶胞密度
,晶胞密度![]() ;正确答案:C3N4;3.59。
;正确答案:C3N4;3.59。


科目:高中化学 来源: 题型:
【题目】4 ℃下,把质量A g摩尔质量为M g·mol-1的可溶性盐RCln 溶解在V mL水中,恰好形成该温度下的饱和溶液,密度为ρ g·cm-3,下列关系式错误的是
A. 溶质的质量分数ω=A/(A+V)×100%
B. 溶质的物质的量浓度c=1 000ρ A/(MA+MV) mol·L-1
C. 该温度下此盐的溶解度S=100A/V g
D. 1 mL该溶液中n(Cl-)= mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是由4个碳原子结合成的6种有机物(氢原子没有画出)
![]()
(1) 写出有机物(a)的系统命名法的名称___________________。
(2) 有机物(a)有一种同分异构体,试写出其结构简式__________________。
(3) 上述有机物中与(c)互为同分异构体的是________(填代号)。
(4) 任写一种与(e)互为同系物的有机物的结构简式____________。
(5) 上述有机物中不能与溴反应并使其褪色的有________(填代号)。
(6) (a)(b)(c)(d)四种物质中,4个碳原子一定处于同一平面的有________(填代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:2Zn(s) + O2(g) =2ZnO(s) ΔH1=-702.2kJ/mol
Hg(l) + ![]() O2(g) =HgO(s) ΔH2=-90.7kJ/mol
O2(g) =HgO(s) ΔH2=-90.7kJ/mol
由此可知Zn(s) + HgO(s) = ZnO(s) + Hg(l)的ΔH3 ,其中ΔH3的值是( )
A. -260.4 kJ/mol B. -254.6 kJ/mol
C. -438.9 kJ/mol D. -441.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧电池若不进行回收利用,将对水体产生严重污染。某兴趣小组对废旧镍电池正极材料[由Ni(OH)2、碳粉、Fe2O3等涂覆在铝箔上制成]进行回收研究,设计实验流程如下图所示:

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+,Cl2能氧化Ni2+为Ni3+;
②NiO+2HCl=NiCl2+H2O;
③Fe3+、Al3+、Ni3+以氢氧化物形式沉淀时溶液的pH如下表所示:
离子 | Fe3+ | Al3+ | Ni2+ |
开始沉淀时的pH | 1.5 | 3.5 | 7.0 |
完全沉淀时的pH | 3.2 | 4.8 | 9.0 |
④Ksp[Ni(OH)2]=5.0×10-16,Ksp(NiC2O4)=4.0×10-10。
请回答下列问题:
(1)酸溶后所留残渣的主要成份__________(填物质名称)。
(2)步骤X的操作为用NiO调节溶液pH,首先析出的沉淀Ⅰ是__________(填化学式),调节过程中pH不能低于___________。
(3)已知溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O,则加入Na2C2O4溶液后析出的沉淀是__________。
(4)写出生成沉淀Ⅲ的离子方程式__________,该反应的平衡常数为__________。
(5)用化学反应方程式表示沉淀Ⅲ转化为Ni(OH)3________________________。
(6)过滤③后如何检验Ni(OH)3已洗涤干净____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酶指具有生物催化功能的高分子物质.在酶的催化反应体系中,反应物分子被称为底物,底物通过酶的催化转化为其他分子.几乎所有的细胞活动进程都需要酶的参与,以提高效率.请回答下列问题:
(1)酶氧化酶与酚类底物在细胞中能实现分类存放,是因为细胞内具有 系统,组成该系统的结构具有的功能特性是 .茶叶细胞中也存在众多种类的酚类物质与酚氧化酶.绿茶制取过程中必须先进行热锅高温炒制,这一过程的目的是 .
(2)茶树的Rubicon酶在CO2浓度较高时,该酶催化C2与CO2反应,Rubicon酶的存在场所为 ;该酶具有“两面性”,在O2浓度较高时,该酶催化C2与O2反应,产物经一系列变化后到线粒体中会产生CO2,其“两面性”与酶的 (特性)相矛盾.
(3)如图中曲线表示将酶在不同温度下保温足够长时间,再在酶活性最高的温度下测其残余酶活性,由图可得出: .为了验证这一结论,请以耐高温的纤维素分解酶为实验材料,比较在低温和最适温度下储存对酶活性的影响,写出实验设计思路: .

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列化合物:①NH4Al(SO4)2、②NH4HSO4、③NH4Cl、④NH3H2O、⑤CH3COONH4, 回答下列问题。
(1)NH4HSO4 的电离方程式为_____
(2)等浓度的②④⑤三种溶液中,NH4+浓度由大到小的顺序是__________。(用序号表示)
(3)室温时,pH=3 的 NH4Cl 溶液中:c(C1ˉ)-c(NH4+) =_________mol·L-1 (填数值)
(4)NH4Al(SO4)2可作净水剂,其理由是___________________________________用必要的化学用语和相关文字说明)
(5)将浓度均为 0.1 mol·L﹣1 的③和④溶液混合,关于所得溶液下列说法错误的是_____
A.若溶液显酸性,则 c(C1ˉ)>c(NH4+ )>c(H+ )>c(OH- )
B.若 c(C1ˉ)=c(NH4+),则溶液显中性
C.若③和④等体积混合,则所得溶液满足关系:c(NH4+)+c(NH3H2O)=0.2mol·L-1
D.其浓度大小不可能为:c(C1ˉ)>c(NH4+)>c(OHˉ)>c(H+)
(6)已知 CH3COONH4 溶液为中性,试推断(NH4)2CO3 溶液的 pH________7 (填“<”“>”“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制溴苯可用如图装置。请回答下列问题:

(1)关闭F夹,打开C夹,向装有少量苯的三口烧瓶的A口加少量溴,再加少量铁屑,塞住A口,则三口烧瓶中发生的有机化学反应方程式为____。
(2)D试管内出现的现象为______;E试管内出现的现象为______。
(3)待三口烧瓶中仍有气泡冒出时打开F夹,关闭C夹,可看到的现象是__________。
(4)从溴苯中除去溴,用NaOH溶液处理后再洗涤,反应的离子方程式为_________。
(5)乙苯的甲基氢原子可以在光照条件下和Cl2发生取代反应,试写出该单取代产物发生消去反应的化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
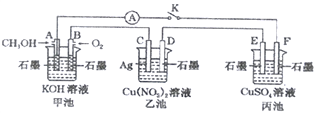
【题目】某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中的溶质足量),当闭合该装置的电键K时,观察到电流表的指针发生了偏转。
请回答下列问题:
(1)甲池为_________(填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为______。
(2)丙池中F电极为____(填“正极”、“负极”、“阴极”或“阳极”),该池总反应的方程式为_____。
(3)当乙池中C极质量减轻4.32g时,甲池中B电极理论上消耗O2的体积为_____mL(标准状况)。
(4)一段时间后,断开电键K。下列物质能使乙池恢复到反应前浓度的是______(填字母)。
A.Cu B.CuO C.Cu(OH)2 D.Cu(OH)2CO3
(5)甲醇和乙醇都可以做燃料。已知乙醇液体完全燃烧生成CO2气体和1mol液态水时放出热量453.3kJ,请写出乙醇燃烧的热化学方程式:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com