
 以下是一些物质的熔沸点数据(常压):
以下是一些物质的熔沸点数据(常压):| 钾 | 钠 | Na2CO3 | 金刚石 | 石墨 | |
| 熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 774 | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
| 1 |
| c4(Na).c3(CO2) |
| 1 |
| c4(Na).c3(CO2) |
| 1 |
| c4(Na).c3(CO2) |
| ②-①×3 |
| 2 |


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
| A、HNO3+KOH═KNO3+H2O |
| B、2NaOH+SiO2═Na2SiO3+H2O |
| C、SO3+H2O═H2SO4 |
| D、2HCl+Na2CO3═2NaCl+H2O+CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2与H2反应生成HCl,而S与H2反应生成H2S |
| B、Cl2与铁反应生成FeCl3,而S与铁反应生成FeS |
| C、Cl2能与水反应,而S不与水反应 |
| D、Cl原子最外层电子数为7,而S原子最外层电子数为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
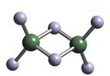 实验测得AlCl3的实际存在形式为Al2Cl6,其分子的球棍模型如图所示.
实验测得AlCl3的实际存在形式为Al2Cl6,其分子的球棍模型如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
c(N
| ||
| c(NH3?H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ⑨ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
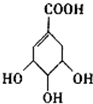 2013年4月1日,一场突如其来的H7N9(禽流感)袭击我国,闹得全国人民人心惶惶,在中国传统的香料和中药八角茴香含有一种重要成分莽草酸,莽草酸是目前世界上被证明是对抗禽流感的最佳良方--“达菲”的原材料.莽草酸的结构简式如图所示
2013年4月1日,一场突如其来的H7N9(禽流感)袭击我国,闹得全国人民人心惶惶,在中国传统的香料和中药八角茴香含有一种重要成分莽草酸,莽草酸是目前世界上被证明是对抗禽流感的最佳良方--“达菲”的原材料.莽草酸的结构简式如图所示查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| N2(g)+3H2(g)?2NH3(g) | CO(g)+NO2(g)?CO2(g)+NO(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com