
【题目】3.52 克铜镁合金完全溶解于50mL、密度为1.400g/cm3、质量分数为63%的浓硝酸中,得到NO2气体3584mL(标准状况),向反应后的溶液中加入适量的1.0mo1/LNaOH溶液,恰使溶液中的金属离子全部沉淀。下列说法不正确的是
A. 合金中铜和镁的物质的量相等
B. 加入NaOH溶液的体积是100mL
C. 得到的金属氢氧化物的沉淀为6.24 克
D. 浓硝酸与合金反应中起氧化性的硝酸的物质的量为0.16 mol
【答案】B
【解析】A.密度为1.40g/cm3、质量分数为63%的浓硝酸的物质的量浓度=![]() mol/L=14mol/L,故A正确;B.加入适量的1.0mol/L NaOH溶液,恰使溶液中的金属离子全部沉淀,此时溶液中溶质为NaNO3,由N元素守恒可知n(NaNO3)+n(NO2)=n(HNO3),则n(NaNO3)=0.05L×14mol/L-
mol/L=14mol/L,故A正确;B.加入适量的1.0mol/L NaOH溶液,恰使溶液中的金属离子全部沉淀,此时溶液中溶质为NaNO3,由N元素守恒可知n(NaNO3)+n(NO2)=n(HNO3),则n(NaNO3)=0.05L×14mol/L-![]() =0.54mol,由钠离子守恒n(NaOH)=n(NaNO3) =0.54mol,故需要1.0mol/L NaOH溶液体积为
=0.54mol,由钠离子守恒n(NaOH)=n(NaNO3) =0.54mol,故需要1.0mol/L NaOH溶液体积为![]() =0.54L=540mL,故B错误;C.由电荷守恒可知,氢氧化物中氢氧根离子的物质的量等于转移电子物质的量,即氢氧根离子的物质的量为0.08mol×(5-4)=0.08mol,故氢氧化物质量=3.52g+0.16mol×17g/mol=6.24g,故C正确;D.起氧化性的硝酸生成NO2气体,根据N原子守恒可知,起氧化剂的硝酸的物质的量=
=0.54L=540mL,故B错误;C.由电荷守恒可知,氢氧化物中氢氧根离子的物质的量等于转移电子物质的量,即氢氧根离子的物质的量为0.08mol×(5-4)=0.08mol,故氢氧化物质量=3.52g+0.16mol×17g/mol=6.24g,故C正确;D.起氧化性的硝酸生成NO2气体,根据N原子守恒可知,起氧化剂的硝酸的物质的量=![]() =0.16mol,故D正确;故选B。
=0.16mol,故D正确;故选B。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】(1)现有下列4种物质:① NO、②浓H2SO4、③ NaHCO3、④SO2其中,遇空气变红棕色的是______(填序号,下同);能使蔗糖变黑的是______;能使品红溶液褪色的是_________。受热分解产生CO2的是______,写出该反应化学方程式_____________________;
(2)青海昆仑玉被定为十年前北京奥运会奖牌用玉,昆仑玉主要成分是由"透闪石"和"阳起石”组成的纤维状微晶结合体,透闪石(Tremolite)的化学成分为Ca2Mg5Si8O22(OH)2透闪石的化学式写成氧化物的形式为:________________________________;
(3)400 mL某浓度的NaOH溶液与5.6 L Cl2(标准状况)恰好完全反应,计算:生成的NaClO的物质的量_____________;该溶液中NaOH的物质的量浓度__________________;
(4)向1L,1mol/L的氯化铝溶液中加入含氢氧化钠xmol的氢氧化钠溶液,当铝元素以Al(OH)3和AlO2-形式存在时x的取值范围是_________________,当x=3.6时,Al(OH)3的质量为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到实验目的且符合操作要求的是
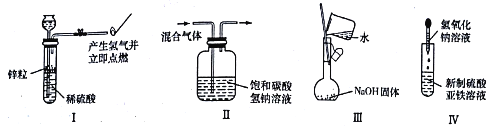
A. I可用于制备并检验氢气的可燃性
B. II可用于除去CO2中的HCl
C. 用Ⅲ来配制一定物质的量浓度的NaOH溶液
D. 用IV中操作制备氢氧化亚铁并观察其颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅笔芯的主要成分是石墨和黏土,这些物质按照不同的比例加以混和、压制,就可以制成铅笔芯。如果铅笔芯质量的一半成分是石墨,且用铅笔写一个字消耗的质量约为1mg。那么一个铅笔字含有的碳原子数约为( )
A. 2.5×1019个 B. 2.5×1022个 C. 5×1019个 D. 5×1022个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容时,NO2和N2O4之间发生反应N2O4(g)2NO2(g),如图所示. 
(1)曲线(填“X”或“Y”)表示N2O4的物质的量随时间变化的曲线.
(2)若降低温度,则v(正) , v(逆) . (填“加快”或“减慢”)
(3)若加入N2O4 , 则v(正) , v(逆) . (填“加快”或“减慢”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定NaOH的质量分数约为82.0%,为了验证其纯度,用浓度为0.2mol/L的盐酸进行滴定,试回答:
(1)托盘天平称量5.0g固体试剂,用蒸馏水溶解于烧杯中,并振荡,然后立即直接转入500mL容量瓶中,恰好至刻度线,配成待测液备用.请改正以上操作中出现的五处错误.① , ② , ③ , ④ , ⑤ .
(2)将标准盐酸装在25.00mL滴定管中,调节液面位置在处,并记下刻度.
(3)取20.00mL待测液,待测定.该项实验操作的主要仪器有 . 用试剂作指示剂时,滴定到溶液颜色由刚好至色时为止.
(4)滴定达终点后,记下盐酸用去20.00mL,计算NaOH的质量分数为 .
(5)试分析滴定偏低误差可能由下列哪些实验操作引起的 .
A.转移待测液至容量瓶时,未洗涤烧杯
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸
C.滴定时,反应容器摇动太激烈,有少量液体溅出
D.滴定到终点时,滴定管尖嘴悬有液滴
E.读数(滴定管)开始时仰视,终点时俯视.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的钠和铝的混合物与足量的水充分反应,没有金属剩余,收到2.24L气体,下列说法一定正确的是
A. 所得气体为氢气 B. 所得气体的物质的量为 0.1 mol
C. 上述过程只发生一个化学反应 D. 所得溶液中只有一种溶质
【答案】A
【解析】钠与水反应生成氢气,铝与氢氧化钠溶液反应生成氢气,所以所得气体为氢气,故A正确;非标准状况下,2.24L气体的物质的量不一定是 0.1 mol,故B错误;上述过程,发生钠与水反应生、铝与氢氧化钠溶液反应,共发生两个化学反应,故C错误;所得溶液中的溶质可能有偏铝酸钠和氢氧化钠两种溶质,故D错误。
点睛:铝能与酸反应放出氢气,铝也能与强碱溶液反应放出氢气,如![]() 。
。
【题型】单选题
【结束】
21
【题目】I.SO2是一种重要的化工原料,其合理利用以及废气处理一直是化工研究的热点。
(1)氧元素在元素周期表中位于第______周期______族,硫原子核外有_____种能量不同的电子。
(2)元素的非金属性S比O______(填“强”或“弱”),从原子结构的角度解释原因:__________。
II.工业上利用反应SO2 + MnO2 → MnSO4 可以制备高纯 MnSO4,实验装置如下图:

(3)请标出反应SO2 + MnO2 → MnSO4的电子转移方向和数目____________
(4)在通入干燥空气的条件下,一段时间后,测得反应后溶液中的 n(SO42-)明显大于 n(Mn2+),请说明原因: ___________________。用化学方程式表示石灰乳的作用: ___________________。
III.SO2可用于处理含 Cr2O72-(铬元素化合价为+6)的废水,最后转化为铬沉淀(铬元素化合价为+3)除去。一种处理流程如下:
![]()
(5)NaHSO3与 Cr2O72-反应时,物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某容积一定的密闭容器中,可逆反应:A(g)+B(g)xC(g),符合下列图象(Ⅰ)所示关系.由此推断对图(Ⅱ)的正确说法是( ) 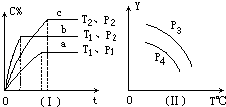
A.p3>p4 , Y轴表示A的质量
B.p3>p4 , Y轴表示混合气体平均摩尔质量
C.p3>p4 , Y轴表示混合气体密度
D.p3<p4 , Y轴表示B的百分含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华人民共和国国家标准(CB2760﹣2011)规定葡萄酒中SO2最大使用量为0.25gL﹣1 . 某兴趣小组用图(a)装置(夹持装置略)收集某葡萄酒中的SO2 , 并对其含量进行测定. 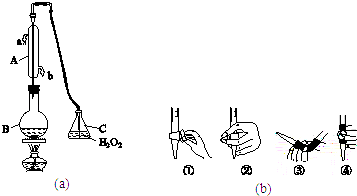
(1)仪器A的名称是 , 水通入A的进口为 .
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中的H2O2完全反应,其化学方程式为 .
(3)除去C中过量的H2O2 , 然后用0.090 0molL﹣1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图(b)中的;若滴定终点时溶液的pH=8.8,则选择的指示剂为;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)(①=10mL,②=40mL,③<10mL,④>40mL).
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为gL﹣1 .
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com