
| A. | 该过程中CeO2没有消耗 | |
| B. | 该过程实现了太阳能向化学能的转化 | |
| C. | 如图中△H1=△H2+△H3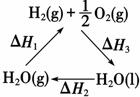 | |
| D. | 以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-═CO2+2H2O |
分析 A、根据题干反应方程式写出总反应:H2O+CO2→H2+CO+O2,反应中CeO2没有消耗;
B、该过程中在太阳能作用下将H2O、CO2转变为H2、CO;
C、根据盖斯定律及图中转化关系进行分析;
D、CO在负极上放电,注意碱性环境对负极反应的影响.
解答 解:A、通过太阳能实现总反应H2O+CO2→H2+CO+O2可知:CeO2没有消耗,CeO2为催化剂,故A正确;
B、该过程中在太阳能作用下将H2O、CO2转变为H2、CO,所以把太阳能转变成化学能,故B正确;
C、由图中转化关系及据盖斯定律可知:-△H1为正值,△H2+△H3为负值,则-△H1=△H2+△H3,故C错误;
D、CO在负极失电子生成CO2,在碱性条件下再与OH-生成CO32-,故负极反应式应为:CO+4OH--2e-═CO32-+2H2O,故D错误;
故选CD.
点评 本题考查了原电池原理、盖斯定律的应用及催化剂的判断,题目难度中等,注意明确盖斯定律的含义及利用盖斯定律求算反应热的方法,明确原电池工作原理.


科目:高中化学 来源: 题型:选择题
| A. | 钠跟水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 铁粉跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液跟稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙跟盐酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
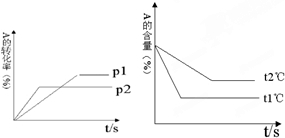 回答下列问题
回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最终可生成0.4 mol SO3 | |
| B. | 当v正(O2)=v逆(SO2)=0时一定达化学平衡 | |
| C. | 升高温度反应速率减小 | |
| D. | 缩小体积增大压强反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
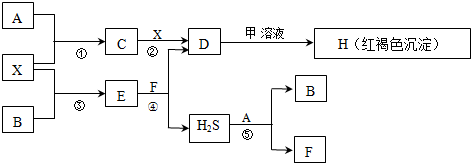
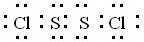 .
.| pH | 1 | 3 | 5 | 7 | 9 | 11 | 13 |
| c(S2-) | 1.4×10-19 | 1.4×10-15 | 1.4×10-11 | 6.7×10-7 | 1.9×10-5 | 1.3×10-3 | 5.7×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
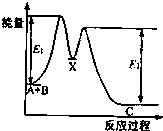 反应A+B→C分两步进行:①A+B→X;②X→C.反应过程中能量变化如图所示.下列有关叙述正确的是( )
反应A+B→C分两步进行:①A+B→X;②X→C.反应过程中能量变化如图所示.下列有关叙述正确的是( )| A. | E2表示反应X→C的反应热 | |
| B. | A+B→C此反应放热 | |
| C. | X是反应A+B→C的催化剂 | |
| D. | 加入催化剂可改变反应A+B→C的反应热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
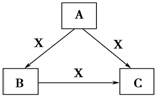 A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )
A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )| A. | 若A、B、C均为焰色反应呈黄色的化合物,则X可为CO2 | |
| B. | 若X为KOH溶液,则A可为AlCl3 | |
| C. | 若X为O2,则A可为硫化氢 | |
| D. | 若X为Cl2,则C可为FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com