
| A. | 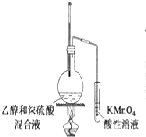 | B. |  | C. |  | D. |  |
分析 不属于氧化还原反应,说明该反应中没有电子转移,即没有元素化合价升降.
解答 解:A.高锰酸钾将生成的乙烯气体氧化成二氧化碳和水,该反应中元素化合价发生变化,所以属于氧化还原反应,故A错误;
B.NaHCO3+HCl=NaCl+CO2↑+H2O中各元素化合价都不变,不属于氧化还原反应,但属于复分解反应,故B正确;
C.铁发生吸氧腐蚀,属于氧化还原反应,故C错误;
D.高锰酸钾将生成的乙炔气体氧化成二氧化碳和水,该反应中元素化合价发生变化,所以属于氧化还原反应,故D错误;
故选B.
点评 本题考查了氧化还原反应,明确元素化合价是解本题关键,根据元素化合价是否变化来判断即可,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 利用生物方法脱除生活污水中的氮和磷,防止水体富营养化 | |
| C. | PM 2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体 | |
| D. | 高纯硅广泛应用于太阳能电池、计算机芯片和光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质氧化性的强弱 | |
| B. | 氢化物沸点的高低 | |
| C. | 氢化物还原性强弱 | |
| D. | 最高价氧化物对应的水化物酸性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
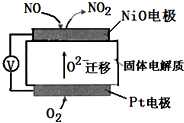 通过 NOx传感器可监测NOx的含量,其工作原理示意图如下,下列说法正确的是( )
通过 NOx传感器可监测NOx的含量,其工作原理示意图如下,下列说法正确的是( )| A. | Pt 电极上发生的是氧化反应 | |
| B. | O2-向正极迁移 | |
| C. | 负极的电极反应式为:NO-2e-+O2-=NO2 | |
| D. | 正极的电极反应式为:O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁、铝及其化合物在生产和生活中有着广泛的应用.
铁、铝及其化合物在生产和生活中有着广泛的应用.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该硫酸的物质的量浓度为18.4 mol•L-1 | |
| B. | 该硫酸与等体积的水混合后所得溶液的质量分数大于49% | |
| C. | 配制200mL 4.6 mol•L-1的稀硫酸需取该硫酸50mL | |
| D. | 该硫酸与等质量的水混合后所得溶液的物质的量浓度大于9.2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 按先后顺序写出检验F中官能团的试剂Br2的CCl4溶液和银氨溶液对应反应的现象是Br2的CCl4溶液褪色和银镜生成
按先后顺序写出检验F中官能团的试剂Br2的CCl4溶液和银氨溶液对应反应的现象是Br2的CCl4溶液褪色和银镜生成 ;
;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com