

| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
分析 Ⅰ.在酸性条件下亚铁离子将重铬酸根还原成铬离子同时生成铁离子,调节pH值,可以使铬离子和铁离子都沉淀,氢氧化铬受热分解得氧化铬,(1)二价铁离子有还原性,Cr2O72-有强氧化性,二者能发生氧化还原反应;
(2)还原+6价铬应选用还原剂,且不能引进新的杂质;
(3)根据各种碱的性质分析判断,过氧化钠有强氧化性,钡离子和硫酸根离子能生成沉淀;根据完全沉淀对应氢氧化物的PH值判断,溶液的PH值应大于该数值;
Ⅱ.电解法是用铁做阳极电解氯化钠溶液,阳极铁放电生成亚铁离子,还原重铬酸根离子,得到铁离子和铬离子,阴极氢离子放电溶液中生成氢氧根离子,与溶液中的铁离子和铬离子生成氢氧化物沉淀,
(4)阴极上氢离子放电生成氢气;
(5)水是弱电解质,导电性能较差,氯化钠是强电解质能增强水的导电性.
解答 解:(1)二价铁离子有还原性,Cr2O72-有强氧化性,二者能发生氧化还原反应,二价铁离子被氧化成三价铁离子,Cr2O72-被还原为Cr3+,反应方程式为Cr2O72-+6Fe2++14H+═2 Cr3++6Fe3++7H2O,
故答案为:Cr2O72-+6Fe2++14H+═2 Cr3++6Fe3++7H2O;
(2)能还原+6价铬,说明加入的物质有还原性,且不能引进新的杂质离子,
A.明矾没有还原性,故错误;
B.铁屑能还原+6价铬,同时本身被氧化成三价铁离子,故正确;
C.生石灰没有还原性,故错误;
D.亚硫酸氢钠能还原+6价铬,同时本身被氧化成硫酸根离子,故正确;
故答案为:BD;
(3)A.Na2O2 有强氧化性,能把Cr3+氧化成Cr6+,从而得不到Cr(OH)3,故错误;
B.Ba(OH)2 和硫酸根离子能产生硫酸钡沉淀,生成杂质,故错误;
C.Ca(OH)2 使Fe3+和Cr3+产生氢氧化物沉淀,且没有其它沉淀杂质生成,故正确;
在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀,且没有氢氧化亚铁沉淀,所以溶液的PH应大于5.6小于9,所以B正确,
故答案为:C; B;
(4)将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解,阳极上铁失电子生成二价铁离子,阴极上氢离子得电子生成氢气,电极反应式为2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-,
故答案为:2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-;
(5)水是弱电解质,所以蒸馏水的导电能力很小,氯化钠是强电解质,在水中能完全电离导致溶液阴阳离子浓度增大,所以能增强溶液导电性;
故答案为:增强溶液导电性.
点评 本题考查了离子方程式和电极反应式的书写,难度不大,答题是注意化学用语的规范书写及工业流程原理的分析,侧重考查学生分析问题和灵活运用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 聚乳酸是一种纯净物 | B. | 其聚合方式与聚苯乙烯相似 | ||
| C. | 其单体为 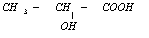 | D. | 聚乳酸是一种线型高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
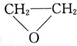
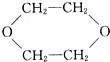
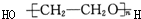
| A. | 只有① | B. | ②③ | C. | ③④ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③② | C. | ③① | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
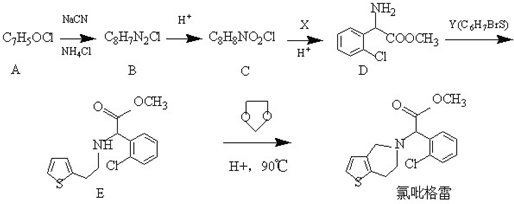
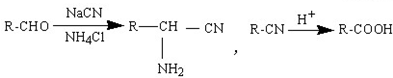
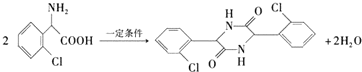 .
.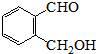 为有机原料制备化合物的合成路线流程图
为有机原料制备化合物的合成路线流程图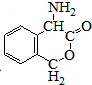 (无机试剂任选).合成路线流程图示例如下:
(无机试剂任选).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和反应是放热反应 | |
| B. | 要加热或高温才能进行的化学反应一定是吸热反应 | |
| C. | 物质发生化学反应一定要有新物质生成但不一定要伴随着能量变化 | |
| D. | 旧的化学键断裂会释放出能量,而要生成新化学键要吸收能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32g O2所含的原子数目为NA | |
| B. | 0.5mol H2O含有的原子数目为1.5NA | |
| C. | 1mol H2O含有的H2O分子数目为NA | |
| D. | 0.5NA个氧气分子的物质的量是0.5mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com