
A. 都比较稳定,密闭存放不产生沉淀
B. 两者均有丁达尔效应
C. 加入硫酸先产生沉淀,后溶解
D. 分散质粒子可透过滤纸
科目:高中化学 来源: 题型:阅读理解
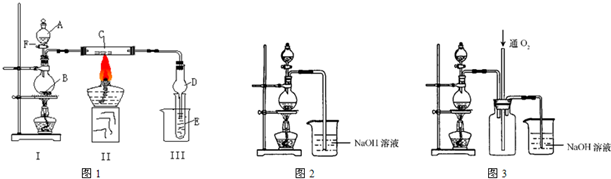
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
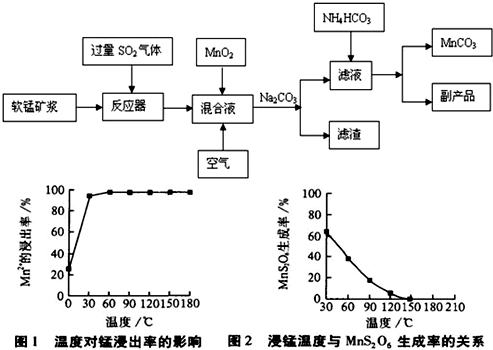
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
 MnS2O6的△H
MnS2O6的△H查看答案和解析>>
科目:高中化学 来源: 题型:
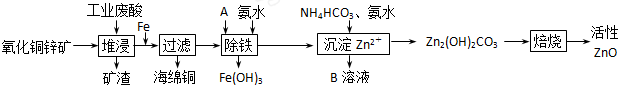
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:021
(综合应用)Fe(OH)3胶体和MgCl2溶液共同具备的性质是…………………( )
A. 都比较稳定,密闭存放不产生沉淀
B. 两者均有丁达尔效应
C. 加入硫酸先产生沉淀,后溶解
D. 分散质粒子可透过滤纸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com