
| A. | 分子中 N-Cl键是非极性键 | B. | 分子中不存在孤对电子 | ||
| C. | 三氯化氮分子结构呈三角锥形 | D. | 因N-Cl 键键能大,它的沸点高 |
分析 A.相同非金属原子之间形成的共价键为非极性共价键,不同原子之间形成的为极性共价键;
B.NCl3中N原子成3个N-Cl键,有1对孤对电子;
C.根据价电子对互斥理论确定微粒的空间构型,NCl3中N原子成3个N-Cl键,还有1对孤对电子,杂化轨道数是4,故N原子采取SP3杂化,分子形状为三角锥形;
D.无氢键的分子晶体的相对分子质量决定其沸点,与其化学键无关.
解答 解:A.不同原子之间形成的为极性共价键,NCl3分子中存在N-Cl极性共价键,故A错误;
B.NCl3中N原子成3个N-Cl键,孤电子对个数=$\frac{5-3×1}{2}$=1,故B错误;
C.NCl3中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{5-3×1}{2}$=4,所以原子杂化方式是sp3,分子形状为三角锥形,故C正确;
D.NCl3晶体为分子晶体,无氢键,分子晶体的相对分子质量决定其沸点,NCl3在常温下是一种淡黄色液体,NCl3沸点低,与相对分子质量有关,与N-Cl键能大无关,故D错误;
故选C.
点评 本题以信息的形式考查NCl3分子空间结构、极性共价键等知识,明确信息并结合所学知识即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的己烷所含的分子数为0.5NA | |
| B. | 28g乙烯在氧气中完全燃烧消耗氧气分子的数目为3NA | |
| C. | 1mol甲基(-CH3)所含的电子总数为10NA | |
| D. | 分子式为C2H6O中含有C-H(碳氢键)的数目为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质有很高的熔点、很大的硬度 | |
| B. | 该物质形成的晶体属分子晶体 | |
| C. | 该物质分子中Si60被包裹在C60里面 | |
| D. | C60易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

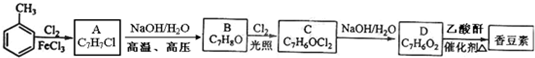
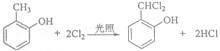 .
.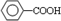 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
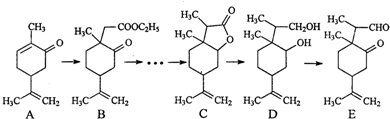
 (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3++3H2O═Fe(OH)3+3H+ | B. | Br-+H2O?HBr+OH- | ||
| C. | CO32-+2H2O?H2CO3+2OH- | D. | NH4++H2O?NH3•H2O+H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com