
已知某溶液中存在OH-、H+、NH4+、Cl- 四种离子。某同学推测其离子浓度大小顺序有如下关系:
①.c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③.c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是_____________________(填化学式)上述四种离子浓度的大小关系为_____________(填序号)
(2)若上述关系中③是正确的,则溶液中的溶质为_____________________(填化学式)
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)______________c(OH-)
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
下表为周期表的一部分,其中的编号代表对应的元素。
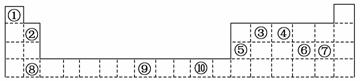
请回答下列问题:
(1)⑩属于 区的元素,在该元素形成的二价离子的溶液中滴加氨水至过量,写出此过程中所有反应的离子方程式: 、
(2)写出元素⑨的基态原子的外围电子排布式
(3)写出与③同主族,其单质用来做半导体的元素符号 、
(4)下表列出了①、④元素形成的化学键的键能:
| 化学键 | ①—① | ①—④ | ④—④ | ④=④ | ④≡④ |
| 键能/kJ·mol−1 | 436.0 | 390.8 | 193 | 418 | 946 |
试写出①、④两单质发生反应的热化学方程式: ,
生成物的VSEPR模型是 ,空间构型为 ,键角为
(5)⑥ 、⑦ 两元素的最高价氧化物对应水化物的酸性最强的化学式是:
查看答案和解析>>
科目:高中化学 来源: 题型:
已知同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列判断中正确的是
A.单质的氧化性按X、Y、Z的顺序增强
B.阴离子的还原性按X、Y、Z的顺序减弱
C.气态氢化物的稳定性按X、Y、Z的顺序增强
D.元素非金属性按X、Y、Z的顺序减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在1.01×105 Pa、298 K条件下,2 mol氢气完全燃烧生成水蒸气放出484 kJ的热量,下列热化学方程式正确的是 ( )
A.2H2(g)+O2(g)===2H2O(l) ΔH=-484 kJ/mol
B.H2(g)+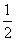 O2(g)===H2O(g) ΔH=-242 kJ/mol
O2(g)===H2O(g) ΔH=-242 kJ/mol
C.H2(g)+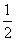 O2(g)===H2O(g) ΔH=+242 kJ/mol
O2(g)===H2O(g) ΔH=+242 kJ/mol
D.2H2(g)+O2(g)===2H2O(g) ΔH=+484 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
HA为酸性略强于醋酸的一元弱酸,在0.1mol/L NaA溶液中,离子浓度关系正确的是( )
A.c(Na+) > c(A-) > c(H+) > c(OH-)
B.c(Na+) > c(A-) > c(OH-) > c(H+)
C.c(Na+) + c(OH-) = c(A-) + c(H+)
D.c(Na+) + c(H+) = c(A-) + c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
A.“地沟油”经加工处理后,可用来制肥皂和生物柴油,可以实现厨余废物合理利用
B.蔗糖、淀粉、油脂及其水解产物中既有电解质也有非电解质
C.在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质
D.离子交换膜在工业生产中广泛应用,如氯碱工业使用了阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
(Ⅰ)碳和碳的化合物在人类生产、生活中的应用非常广泛。“低碳生活”不再只是一种理想,更是一种值得期待的生活方式。
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活。  (2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。
其负极电极反应式是: 。
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
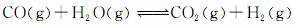 ,得到如下三组数据:
,得到如下三组数据:

①实验1中,以v( H2)表示的平均反应速率为: 。
②该反应的正反应为 (填“吸”或“放”)热反应;
③若要实验3达到与实验2相同的平衡状态(即各物质的体积分数分别相等),则a、b应满足的关系是 (用含a、b的数学式表示)。
(Ⅱ)某小组运用工业上离子交换膜法制烧碱的原理,用如下图所示装置电解K2 SO4溶液。
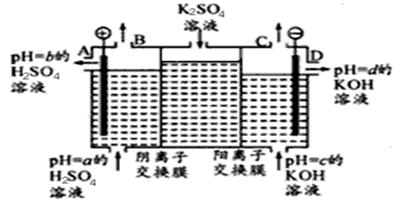
①该电解槽中通过阴离子交换膜的离子数 (填“>”“<”或“=”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为 ;
③电解一段时间后,B出口与C出口产生气体的质量比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在0.1mol/L的醋酸溶液中存在下列平衡:CH3COOH 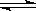 H++CH3COO-,要使该平衡右移且使氢离子浓度增大,应采取的措施是
H++CH3COO-,要使该平衡右移且使氢离子浓度增大,应采取的措施是
A.加入NaOH B.加入盐酸 C.加水 D.升高温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com