
分析 (1)KSCN溶液检验三价铁离子,稀盐酸酸化的氯化钡溶液检验硫酸根离子;
(2)反应CuS+4HNO3=Cu(NO3)2+2NO2↑+S↓+2H2O中,S元素化合价由-2价升高高0价,被氧化,N元素化合价由+5价降低到+4价,结合元素的化合价以及反应的方程式计算;
(3)电解质:在水溶液中或熔融状态下能够导电的化合物;
非电解质:在熔融状态和水溶液中都不能导电的化合物;
解答 解:(1)KSCN溶液检验三价铁离子,若溶液变红,则有三价铁;稀盐酸酸化的氯化钡溶液检验硫酸根离子,若有白色不溶的沉淀产生,则有硫酸根离子,
故答案为:KSCN溶液;稀盐酸和BaCl2溶液;
(2)由反应CuS+4HNO3=Cu(NO3)2+2NO2↑+S↓+2H2O可知,S元素的化合价由-2价升高到0,N元素的化合价由+5降低为+4价,
则转移2mol电子时被还原的硝酸为2mol,当转移电子数为1.806×1023时,电子的物质的量为$\frac{1.204×1{0}^{23}}{6.02×1{0}^{23}/mol}$=0.2mol,
故答案为:0.2mol;
(3)①水银为金属,存在自由移动的电子,能导电,既不是电解质也不是非电解质;
②熔融的烧碱存在自由移动的离子,能导电,是电解质;
③干冰是固态二氧化碳,二氧化碳自身不能电离,不能导电,是非电解质;
④氨水是混合物,既不是电解质也不是非电解质,但氨水中存在自由移动的离子,能导电;
⑤碳酸氢钠固体不导电,在水中能导电,是电解质;
⑥盐酸中存在自由移动的离子,能导电,但盐酸是混合物,既不是电解质也不是非电解质;
⑦蔗糖在水中和熔化状态下都不能导电,是非电解质;
⑧氯化钠晶体不导电,在水中能导电,是电解质;
⑨纯硫酸不导电,在水中能导电,是电解质;
故能导电的是:①②④⑥,属于电解质的是:②⑤⑧⑨,
故答案为:①②④⑥、②⑤⑧⑨.
点评 本题考查离子的检验方法、电解质和非电解质的概念、物质的导电性、氧化还原反应等知识,理解概念定理,明确元素的化合价及电子守恒、质量守恒定律即可解答,难度不大,


科目:高中化学 来源: 题型:解答题
 +2H2O;
+2H2O;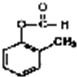 发生银镜反应的化学方程式:
发生银镜反应的化学方程式: +2Ag(NH3)2OH$\stackrel{水浴加热}{→}$
+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$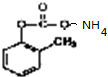 +2Ag↓+3NH3+H2O;
+2Ag↓+3NH3+H2O; 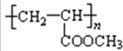 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
| 腐蚀快慢 | 较快 | 慢 | 较快 | ||||
| 主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2- |
| A. | 在pH<4的溶液中,碳钢主要发生析氢腐蚀 | |
| B. | 在pH>6的溶液中,碳钢主要发生吸氧腐蚀 | |
| C. | 在pH>14的溶液中,碳钢腐蚀的正极反应为O2+4OH-+4e-═2H2O | |
| D. | 在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
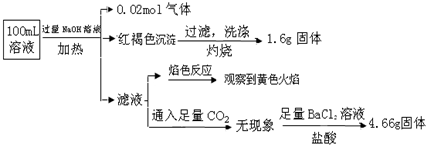
| A. | 原溶液中c(Fe3+)=0.2 mol•L-1 | |
| B. | 溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol•L-1 | |
| C. | SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在 | |
| D. | 取少量原溶液于试管中,加入KSCN溶液,溶液成血红色,说明该溶液一定没有Fe2+,只有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
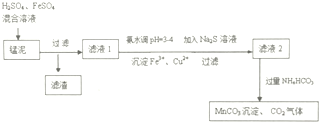
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率用于衡量化学反应的快慢 | |
| B. | 决定反应速率的主要因素是反应物的性质 | |
| C. | 可逆反应达到化学平衡时,正、逆反应速率都为零 | |
| D. | 化学反应中,纯液体物质不能计算其速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com