
| 固体催化剂 |
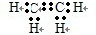 ,
,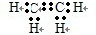 ;H2O;
;H2O;| 稀硫酸 |
| △ |
| 稀硫酸 |
| △ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、Fe3O4和Fe的混合物 |
| B、Fe3O4和FeO的混合物 |
| C、Fe3O4和Fe2O3的混合物 |
| D、Fe3O4、FeO和Fe的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH、Na2CO3都属于碱 |
| B、HNO3、HClO都属于酸 |
| C、SO2、CO都属于酸性氧化物 |
| D、H2SO4、SO3都属于电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、甲池中,Cu极上有气泡放出 |
| B、发现a点附近显红色 |
| C、电子走向Zn→a→b→C2 |
| D、乙池溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
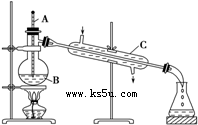 如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:

| 温度T(K) | 273K | 323K | 373K |
| 平衡常数 | 0.005 | 0.022 | 0.36 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)现有反应:mA(g)+nB(g)?pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)现有反应:mA(g)+nB(g)?pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:| c(B) |
| c(C) |
查看答案和解析>>
科目:高中化学 来源: 题型:
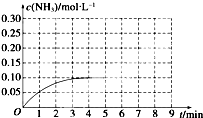
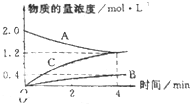 如图,曲线表示在800℃时,和某反应有关的物质A、B、C的物质的量浓度从开始反应至4分钟时的变化图象,试回答:
如图,曲线表示在800℃时,和某反应有关的物质A、B、C的物质的量浓度从开始反应至4分钟时的变化图象,试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com