
| A. | 断开化学键的过程会放出能量 | |
| B. | 吸热反应中,反应物的总能量小于生成物的总能量 | |
| C. | 加热才能发生的反应一定是吸热反应 | |
| D. | 氧化反应均为吸热反应 |
分析 A.断开化学键吸收能量,形成化学键放出能量;
B.反应物的总能量小于生成物的总能量,为吸热反应;
C.物质的燃烧也需要加热达到可燃物的着火点;
D.有的氧化反应放热有的吸热.
解答 解:A.断开化学键的过程会吸收能量,形成化学键的过程会放出能量,故A错误;
B.反应物的总能量小于生成物的总能量,为吸热反应,反应物的总能量大于生成物的总能量,为放热反应,故B正确;
C.物质的燃烧也需要加热达到可燃物的着火点,但燃烧反应都是放热反应,故C错误;
D.食物的腐败变质是氧化反应,该过程是放热的,故D错误;
故选B.
点评 本题考查化学反应中能量的转化的原因,题目难度不大,注意反应吸热或放热与反应的条件没有必然关系.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
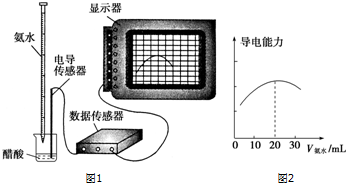
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A |  | 1,5-二甲基-3-乙基苯 |
| B |  | 异戊二烯 |
| C |  | 2,5-二甲基-5-庚醇 |
| D | CH3 CH2CH2(C2H5)CHCH(CH3)2 | 2-甲基-3-正丙基戊烷 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇代替汽油作燃料,污染小,更环保 | |
| B. | 1mol 乙醇燃烧生成3mol水 | |
| C. | 1mol 乙醇与足量Na反应生成0.5 mol H2 | |
| D. | 乙醇可以制饮料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,则Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS | |
| B. | Fe能与CuSO4溶液反应,可知Al与CuSO4溶液也能反应 | |
| C. | CaS03与稀盐酸反应生成SO2,可知CaSO3与稀硝酸反应也生成SO2 | |
| D. | 已知H2O2能氧化I一,可知H2O2也能氧化Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是个放热反应 | |
| B. | 反应物的总能量高于生成物的总能量 | |
| C. | H2O2仅为氧化剂 | |
| D. | H2O2既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
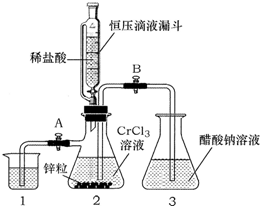 酣酸亚铬晶体是一种氧气吸收剂,化学式为[Cr(CH3COO)2]2•2H2O,不溶于冷水,易溶于盐酸.由于Cr2+易被氧气氧化,制备醋酸亚铬时,需在封闭体系中用锌作还原剂,先将Cr3+还原为Cr2+,再与醋酸钠溶液作用制得,其总反应为:
酣酸亚铬晶体是一种氧气吸收剂,化学式为[Cr(CH3COO)2]2•2H2O,不溶于冷水,易溶于盐酸.由于Cr2+易被氧气氧化,制备醋酸亚铬时,需在封闭体系中用锌作还原剂,先将Cr3+还原为Cr2+,再与醋酸钠溶液作用制得,其总反应为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 3 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com