
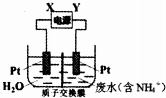
| A. | 直流电源中X为负极 | |
| B. | 阳极反应为2NH4+-6e-=N2↑+8H+ | |
| C. | 阴极反应为2H2O+2e-=H2↑+2OH- | |
| D. | 当有6mol电子转移时,质子交换膜两侧电解质溶液质量变化差为32 g |
分析 用电解法处理含有NH4+的废水,使之变为N2,在阳极上是铵根失电子变为氮气分子的氧化反应2NH4+-6e-=N2↑+8H+,在阴极上是氢离子得电子的还原反应2H2O+2e-=H2↑+2OH-,根据电极反应式结合电子守恒进行计算回答.
解答 解:A、用电解法处理含有NH4+的废水,使之变为N2,在阳极上是铵根失电子变为氮气分子的氧化反应,所以Y是正极,X是负极,故A正确;
B、在阳极上是铵根失电子变为氮气分子的氧化反应2NH4+-6e-=N2↑+8H+,故B正确;
C、在阴极上是氢离子得电子的还原反应2H2O+2e-=H2↑+2OH-,故C正确;
D、当有6mol电子转移时,2NH4+-6e-=N2↑+8H+,阳极附近电解质质量减小28g,2H2O+2e-=H2↑+2OH-,阴极上电解质质量减小6g,质子交换膜两侧电解质溶液质量变化差是22g,故D错误.
故选D.
点评 本题考查电解原理,为高频考点,把握阴阳极上发生的电极反应是解答本题的关键,注意电极反应式的书写和电子守恒的应用,题目难度不大.


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用活性炭吸附新装修居室里的有害气体 | |
| B. | 用K2Cr2O7检查司机是否酒后驾车 | |
| C. | 用盐酸清洗陶瓷面盆上的铁锈迹 | |
| D. | 用石灰水吸收燃煤烟气中的SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的气化、煤的液化和煤的干馏均属于化学变化 | |
| B. | 淀粉、纤维素、油脂、蛋白质均属于高分子化合物 | |
| C. | 棉花、羊毛和蚕丝都属于天然高分子 | |
| D. | 陶瓷、水泥和玻璃均属于硅酸盐材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com